中国每年等待器官移植的患者数以十万计,而得到供源的少之又少,这不仅直接影响病患的生存情况,甚至还涉及到违法人体器官交易的社会伦理问题。那么,是否可以寻找替代资源?
2022年1月,马里兰大学医学中心的外科团队将一头基因修饰过的猪的心脏移植给了心衰患者大卫·贝内特,帮他延续了将近两个月的生命,后或因猪病毒感染而死。但对于异种移植器官技术而言,这8周具有划时代的意义,这个案例引起一时轰动,同时,猪作为理想的人类器官供源在移植学界也逐渐趋于共识。
除了器官移植中常见的免疫排斥外,科学家们同样担心猪自身携带的病毒感染的问题,当给予进行移植手术的病患必要的免疫抑制药物后,这个风险尤为值得重视。
近日,德国兰根保罗-埃利希研究所的Ralf R. Tönjes教授团队在Journal of Virology上发表最新研究,证明通过基因编辑从猪基因组中去除PERV-C逆转录病毒基因组是可能的,这将有助于异种移植的病毒学安全性。

来源:https://doi.org/10.1128/jvi.00062-23
猪体内存在的诸多病毒可能导致的跨物种感染风险,是进行异种器官移植必须考虑的问题,其中,猪内源性逆转录病毒(porcine endogenous retroviruses,PERVs)是对人体具有较高风险的RNA病毒,无法通过无菌培养和筛选等传统措施排除。三种类型的PERV感染能力不同,PERV-A和PERV-B可以克服物种障碍,在传播后可能感染人类,而PERV-C逆转录病毒主要感染猪细胞,而不是人类细胞,但PERV-C可以与PERV-A重组,产生PERV-A/C,进而感染人体细胞。
这也是为什么目前选择单倍型SLAD/D品种猪作为移植供体的原因,该品种猪没有完全功能的PERV-A和PERV-B基因组,但可能是PERV-C基因组携带者,因此,有必要对SLAD/D品种猪中所有的基因组PERV-C位点进行表征。
在这篇文章中,研究人员首先利用PERV-C阳性单倍型SLAD/D猪外周血单核细胞的基因组DNA构建噬菌体lambda文库,用特定的放射性标记探针对该库进行PERV-C筛选,从中分离出全长PERV-C前病毒克隆561号,并由此生成几个全长PERV-C前病毒,这里选择了PERV-C(5634)和PERV-C(5683)两个克隆。
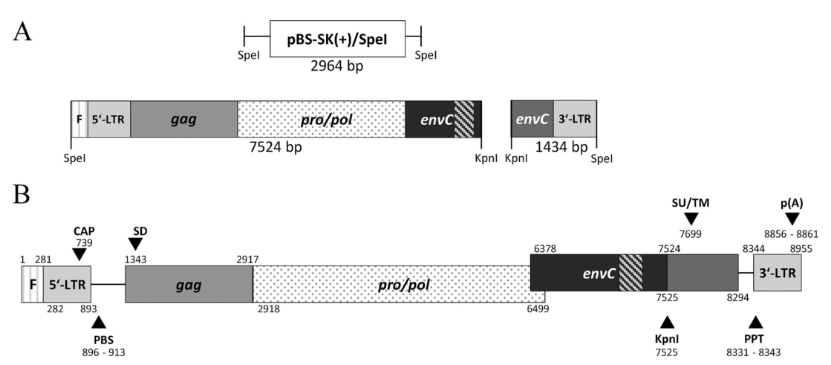
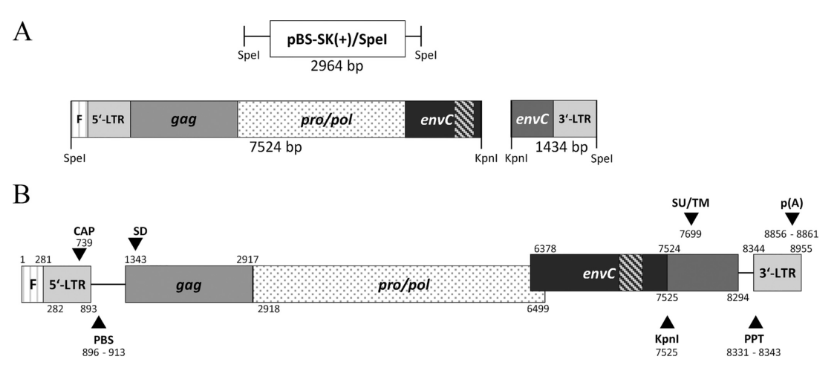
图1. 从SLAD/D单倍型小型母猪基因组中分离出的全长PERV-C克隆的基因组组织。图片来源:https://doi.org/10.1128/jvi.00062-23
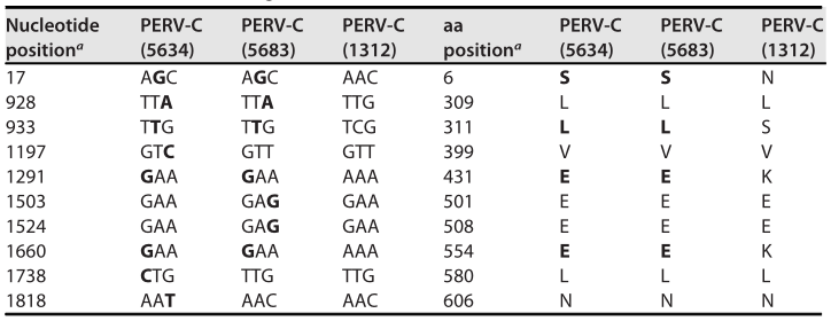
图2. PERV-C克隆env基因的替换。来源:https://doi.org/10.1128/jvi.00062-23
接下来研究人员对PERV-C(561)的复制和感染能力进行了检测,并与已被鉴定具有复制能力的PERV-C(1312)进行比较。将PERV-C(5634)和PERV-C(5683)前病毒转染ST-IOWA细胞,在转染后9天检测到病毒逆转录酶(RT)活性,比PERV-C(1312)早4天,转染两周PERV-C(5634)达到最大值210 mU/mL, PERV-C(5683)达到最大值 256 mU/mL,比阳性对照PERV-C(1312)高5-10倍。在观察期结束时,PERV-C克隆的RT活性均在100至200 mU/mL范围内,表明其可以在细胞培养中稳定繁殖。
随后,在第20天收集转染细胞培养物的无病毒细胞上清,通过测量PERV-C克隆的RT活性以及定量包裹在病毒颗粒中的envC特异性病毒RNA (vRNA)来检测PERV-C克隆的感染性。qRT-PCR结果显示PERV RT活性和PERV RNA均可以被检测到,PERV vRNA从第7天到第56天复制不断增加,在此期间,通过巢式PCR检测感染ST-IOWA细胞中的前病毒envC DNA,证明PERV-C(5634)和PERV-C(5683)在体外具有较强的复制能力和感染性。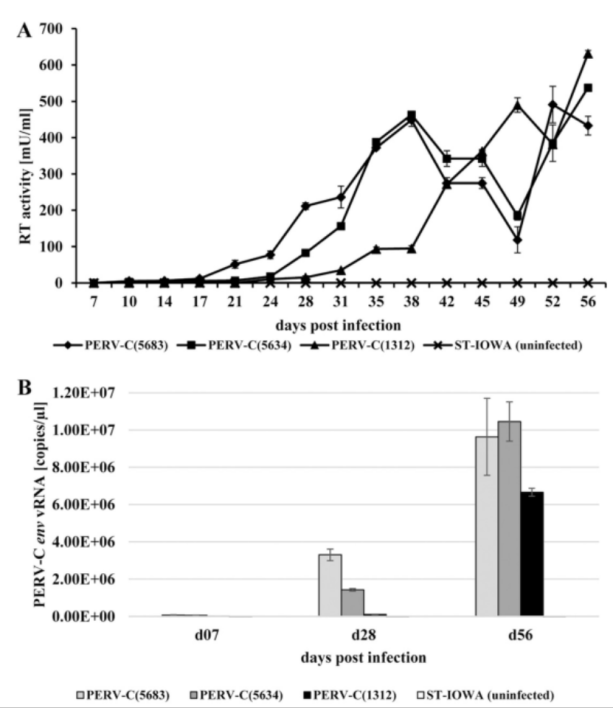
图3. 全长PERV-C克隆复制能力检测。图片来源:https://doi.org/10.1128/jvi.00062-23
为了验证重组PERV-C的真实性,通过PCR产物测序证实了其结构,两个克隆都产生了功能性和感染性的逆转录病毒,说明该品种猪至少含有一个全长PERV-C前病毒,通过对重组克隆PERV-C(561)进行染色体定位,发现染色体位置与先前验证的PERV-C(1312)原病毒不同。
总的来说,单倍型SLAD/D猪的PERV-C在体外具有很强的复制能力和感染性,但这些PERV-C位点可以通过基因编辑敲除,降低异种器官移植时的病毒感染风险。
尽管从动物福利的立场来看,动物整体福利水平也许会受到损害,但异种器官移植是纾解病患苦难的人道主义措施,符合医学伦理中的有利原则。随着科技的进步,我们也期待着有朝一日它们能够成为安全的供体来挽救更多病患的生命。
转载来源:生物谷
参考资料:
[1] Rodrigues Costa M, Fischer N, Gronewold A, Gulich B, Godehardt AW, Tönjes RR. Isolation of an Ecotropic Porcine Endogenous Retrovirus PERV-C from a Yucatan SLAD/D Inbred Miniature Swine. J Virol. 2023 Mar 8: e0006223. doi: 10.1128/jvi.00062-23.
[2] Reardon S. Will pigs solve the organ crisis? The future of animal-to-human transplants. Nature. 2022 Nov;611(7937):654-656. doi: 10.1038/d41586-022-03794-2.
[3]许艺红,肖义军.猪作为人类器官移植供体的研究进展[J].生物学通报,2022,57(11):1-4.