导语:在大众的认知里,艾滋病等同于不治之症。但是,近些年的研究发现携带抗HIV基因(CCR5纯合缺失,CCR5-Δ32/Δ32)的造血干细胞移植(HSCT)可以治疗甚至治愈1型艾滋病。从白种人“柏林患者”到拉丁裔“伦敦患者”再到后来的多种族混血“纽约患者”,都证明CCR5-Δ32/Δ32 HSCT适用于多种族的HIV治疗。最近,Nature medicine发布了科研人员对接受CCR5-Δ32/Δ32 HSCT艾滋病患者进行的最长、最精确的诊断监测数据,并发现其能治愈艾滋病的证据。
艾滋病治愈病例的共性:CCR5-Δ32/Δ32 HSCT
艾滋病是由两种逆转录病毒HIV-1和HIV-2中的一种所导致的感染,HIV-1在全球范围内造成了大规模HIV感染,而HIV-2造成的感染则主要集中在西非。趋化因子CCR5和CXCR4,是HIV-1入侵机体细胞的主要辅助受体。CCR5基因上一小段突变,使细胞对HIV具有抵抗力。CCR5突变在欧洲人中携带比例约为1%,非洲人、亚洲人和南美洲人则很少携带该突变,中国汉族人携带比例仅为0.16%,维吾尔族人则高达3%。
围绕CCR5基因变异的艾滋病治愈,已有4个先例,分别是“柏林病人”、“伦敦病人”、“纽约病人”和“希望之城”。
1柏林病人
2008年11月,NEJM报道了世界首例艾滋病治愈病例:一名生活在柏林,同时患有艾滋病和白血病的41岁白种人男子(Timothy Brown)在接受了CCR5-Δ32/Δ32 HSCT后,体内的HIV下降至检测不出的水平。这名病人被称为“柏林病人”。

图1 柏林病人Timothy Brown(右)和他的医生Gero Hϋtter(左)(图源:Robert Hood)
2波士顿病人
2008年-2010年,美国波士顿布莱根妇女医院为两名既感染HIV又患有淋巴癌的患者进行了骨髓移植手术,但移植的骨髓只是配型合适,却没有CCR5-Δ32/Δ32。术后8个月两人体内的HIV下降至检测不出的水平。但是,一名病人在停止服用抗逆转录病毒药物12周后,体内再次检测出HIV,另一名在停药32周后,也再次检测出HIV。专家认为由于移植的供者骨髓没有CCR5-Δ32/Δ32,因而不能抵御HIV,一旦停药时间较长,隐藏于患者体内的HIV又会死灰复燃。

图2 “波士顿病人”专题报道(图源:央视新闻)
3伦敦病人
2020年3月,The lancet报道了世界第二个艾滋病治愈案例:一名同时患有艾滋病和霍奇金淋巴瘤的拉丁裔英国男性(Adam Castillejo),接受了CCR5-Δ32/Δ32 HSCT。术后16个月,患者体内的HIV下降至检测不出的水平。移植后35个月,他的白细胞不能被依赖CCR5的艾滋病病毒株感染,血浆中HIV-1病毒载量一直低于检测限而无法被检测到。这名病人被称为“伦敦病人”。

图3 40岁的Adam Castillejo(图源:New York Times)
4纽约病人
2022年2月15日,加州大学洛杉矶分校儿科传染病主任、医学博士、研究员Yvonne Bryson在2022年举行的逆转录病毒和机会性感染会议上表示一名多种族背景的艾滋病病毒感染者通过脐带血干细胞移植治愈。这名患者为中年混血女性,同时患有艾滋病和白血病。患者接受了来自脐带库脐带血的移植,该脐带血携带CCR5-Δ32/Δ32。术后,患者HIV病毒载量降低到无法检出水平,并将这种状态一直持续到现在。

图4 “纽约病人”治疗团队(图源:NBC News)
5希望之城
2022年7月,美国最大的癌症研究和治疗组织之一(希望之城)宣布了一名艾滋病患者经干细胞移植后,实现艾滋病长期缓解的病例。这位今年67岁的高加索男子被称为“希望之城”,是世界上第四位实现艾滋病长期缓解的病人。他携带艾滋病病毒(HIV)超过32年,也是四人中携带HIV病毒时间最长、最年长的一位。这名患者同时患有急性髓系白血病,并接受了CCR5-Δ32/Δ32 HSCT。至今,没有证据表明该患者体内的HIV RNA反弹,也没有检测到HIV DNA。

图5 “希望之城”治疗团队(图源:City of Hope)
这几个治愈案例的不同之处在于:“柏林病人”、“伦敦病人”和“希望之城”接受了骨髓移植,“纽约病人”接受了脐带血移植;共同之处在于:同时患有艾滋病和血癌,并接受了含有CCR5-Δ32/Δ32基因的移植。结合“波士顿病人”的反证,说明含有CCR5-Δ32/Δ32基因的骨髓移植或许适用于不同种族,不同性别,且同时患艾滋病和血癌的患者治疗。
第五例治愈者:CCR5-Δ32/Δ32 HSCT+HIV+白血病
2023年2月20日,Nature Medicine发布了第5位经干细胞移植实现艾滋病治愈的病例研究。该研究由德国杜塞多夫大学医院主导,因此将该病人称为“杜塞尔多夫病人”。这名53岁的男性艾滋病患者在2011年1月患上了急性髓系白血病,并在2013年2月接受了一位女性捐赠者的CCR5-Δ32/Δ32 HSCT,其后进行了化疗和供者淋巴细胞输注。干细胞移植后,他仍继续接受抗逆转录病毒治疗,但患者外周血单核细胞中已无法检测到HIV-1。2018年11月,在接受干细胞移植近6年后,“杜塞尔多夫病人”同意停止抗逆转录治疗,以观察是否会出现病毒反弹。48个月后,研究团队在患者血浆中没有观察到HIV-1 RNA反弹,也没有对HIV-1蛋白的免疫反应增强。研究人员宣布“杜塞尔多夫病人”治愈,并称这是CCR5-Δ32/Δ32 HSCT治愈HIV-1的有力证据。
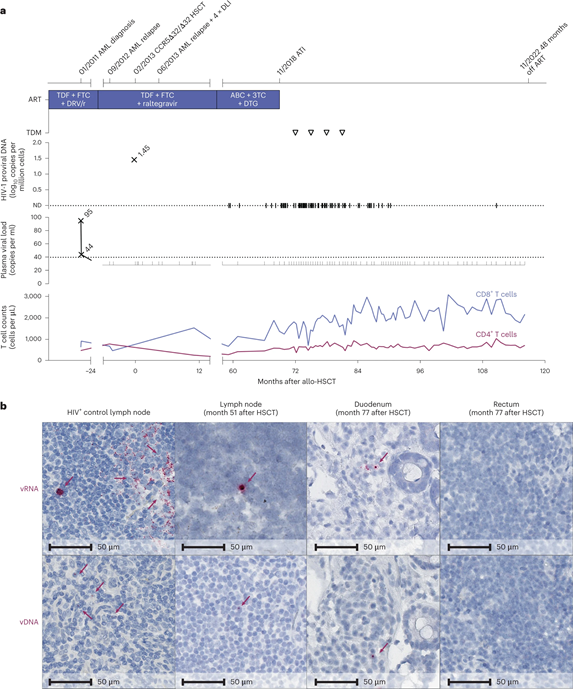
图6 分析性治疗中断前后的临床过程和HIV-1病毒库(图源:[3])
利用何种趋化因子受体侵入细胞决定了HIV-1病毒株的嗜性。单核细胞/巨噬细胞嗜性的病毒株利用趋化因子受体CCR5侵入细胞,称为R5嗜性;T细胞嗜性的病毒株利用趋化因子受体CXCR4侵入细胞,称为X4嗜性;而既能利用CCR5,又能利用CXCR4侵入细胞的病毒株称为R5/R4嗜性。CCR5-Δ32的突变使细胞对CCR5(R5)嗜性HIV免疫。
先前CCR5-Δ32/Δ32 HSCT治愈HIV-1的案例已有详细分析,但样本量少,缺乏对照的前瞻性研究。因此,这些病例与治愈HIV-1的关系并不确定。然而,有两个相似之处对结果至关重要:所有患者均携带R5-嗜性病毒株,但在接受CCR5-Δ32/Δ32 HSCT后都获得了长期缓解。虽然CCR5-Δ32/Δ32 HSCT不能防止X4-嗜性病毒的反弹,但这种对宿主免疫系统的改变是防止R5-嗜性病毒HIV感染者病毒再繁殖的一个关键因素。
此外,通过化疗和移植细胞清除HIV-1感染的细胞,可能共同导致HIV-1的治愈。然而,在这个案例和其他案例中,HIV-1感染细胞耗竭的必要程度和助力HIV-1治愈的程度,仍然难以捉摸。本研究的一个局限性是,在HSCT前后,可直接用于详细的免疫学和病毒学分析的样本非常少。
尽管使用具有CCR5-Δ32/Δ32突变的供体进行HSCT既不是低风险也不是可以大规模复用的操作,但一些移植携带CCR5-Δ32/Δ32的造血干细胞后HIV-1成功长期缓解的报道,强调了它可能和治疗策略高度相关。对于没有血液恶性肿瘤的HIV患者,通过基因编辑技术,将CCR5-Δ32突变引入野生型干细胞,配合降低HIV感染细胞治疗,可能有助于治愈HIV。“杜塞尔多夫病人”提供了分析性治疗中断前后病毒学和免疫学特征的详细信息,并产生了有价值的见解,希望能指导未来的艾滋病治愈策略。
参考资料:
[1]Jensen, BE.O., Knops, E., Cords, L. et al. In-depth virological and immunological characterization of HIV-1 cure after CCR5Δ32/Δ32 allogeneic hematopoietic stem cell transplantation. Nat Med (2023). https://doi.org/10.1038/s41591-023-02213-x
[2]Gupta RK, Peppa D, Hill AL, et al. Evidence for HIV-1 cure after CCR5Δ32/Δ32 allogeneic haemopoietic stem-cell transplantation 30 months post analytical treatment interruption: a case report. Lancet HIV. 2020 May;7(5):e340-e347. doi: 10.1016/S2352-3018(20)30069-2. Epub 2020 Mar 10. PMID: 32169158; PMCID: PMC7606918.
[3]Jensen, BE.O., Knops, E., Cords, L. et al. In-depth virological and immunological characterization of HIV-1 cure after CCR5Δ32/Δ32 allogeneic hematopoietic stem cell transplantation. Nat Med (2023). https://doi.org/10.1038/s41591-023-02213-x