作为造血组织的核心成分,造血干细胞(Hematopoietic stem cell,HSC)可进行自我更新,并拥有在适当条件下向多个方向分化为各系造血细胞的能力。HSC移植可在对某些癌症和遗传疾病进行高剂量清髓治疗后恢复造血功能。从人类多能干细胞(Pluripotent stem cell,PSC)系中制造可移植的HSC可能会解决目前HSC捐献短缺问题,并可提供充足的转基因干细胞来源来治疗遗传性血液疾病,包括免疫缺陷和代谢疾病。
自2006年以来,科学家就已经关注了诱导性多能干细胞(Induced pluripotent stem cells,iPSCs),但如何在实验室中人工安全地模拟人体内的细胞分化,以提供有针对性的医学治疗尚存难点。在过去的几十年里,生物医学工程师一直在尝试在实验室中制造造血干细胞,以解决供体造血干细胞短缺的问题。但目前还没有人能够实现这一目标。部分问题在于,科学家仍然不完全了解胚胎发育微环境中发生的所有过程,但是这些过程可诱导在胚胎发育的第32天左右产生造血干细胞。
要解决造血干细胞的人工制造问题,需要先了解造血干细胞的形成过程。心血管系统和主动脉的发育与最终造血功能的发育密不可分。在胚胎发育过程中,血细胞通过内皮-造血转换(Endothelial-to-hematopoietic transition,EHT)过程从造血内皮细胞衍生而来,EHT最初发生在卵黄囊中,然后发生在胚胎中。在胚胎中,成体HSC的前体首先出现在主动脉-性腺-中肾(Aorta-gonad-mesonephros,AGM)区域,形成主动脉内造血簇(Intra-aortic hematopoietic clusters,IAHC)。从人类胚胎干细胞(Human embryonic stem cells,hESCs)分化出HOXA+造血脉管系统是AGM衍生的造血干细胞谱系发育所必需的。脉动性主动脉血流产生主动脉壁剪切应力和周向拉伸被假设为驱动EHT的机械因素,但是其对HOXA+造血生态位和AGM衍生的造血干细胞谱系发育的影响尚未可知。
2022年9月13日,澳大利亚新南威尔士大学和墨尔本大学的研究团队在Cell Reports发表题为“Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development”的研究成果(图1)[1]。研究表明在实验室中使用微流体设备模拟胚胎心脏跳动,可诱导人类造血干细胞前体的发育,这些前体可进一步发育成造血干细胞。

图1 研究成果(图源:[1])
此项研究使用3cm x 3cm的微流体系统泵送从胚胎干细胞系产生的血液干细胞来模拟胚胎的心脏跳动和血液循环(图2),旨在验证血液循环流动及其产生的剪切应力促进胚胎血液发育的假设。
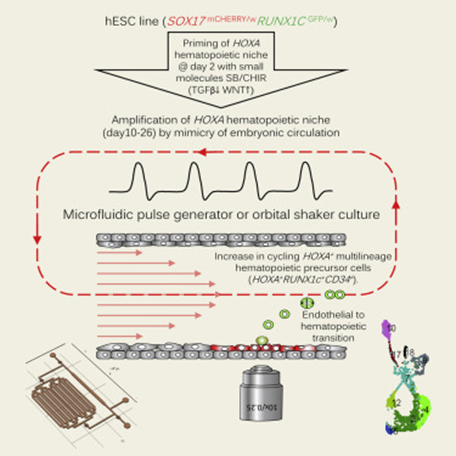
图2 模拟胚胎血流的微流体泵送系统(图源:[1])
S1:微流体脉冲发生器演示(图源:[1])
研究发现:
01 胚胎循环微流体模拟诱导人类造血干细胞前体的发育
由于无法进行人类胚胎主动脉中EHT的直接可视化,目前只能依赖于显微解剖的人类胚胎主动脉的单细胞转录组学和hESC衍生造血的体外分析。因此,研究人员开发了一种微流体脉冲发生器(Microfluidic pulse generator,MPG)来模拟和观察胚胎循环对hESC衍生的血液形成的影响(S1、图3A和3B)。MPG驱动循环体积为2-3 μL的微流体回路周围的流动(图3C)。
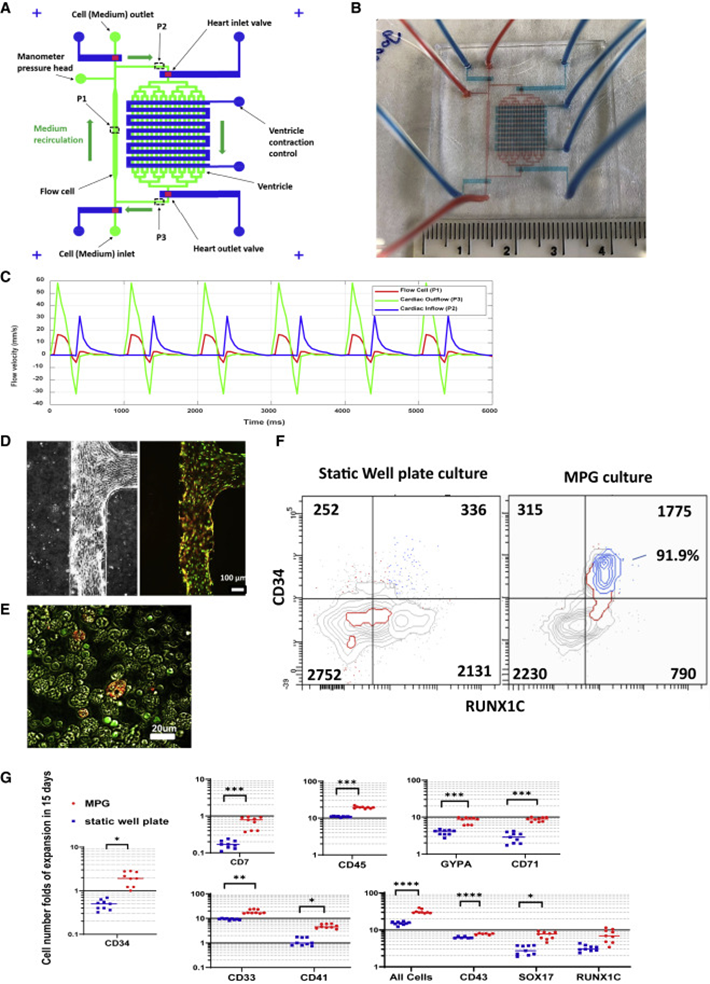
图3 微流控脉冲发生器SB/CHIR分化培养(图源:[1])
S2:脉动流对在微流体脉冲发生器流动层内生长的贴壁成纤维细胞的影响(图源:[1])
研究发现MPG培养产生的循环细胞中有很大一部分是CD34+ RUNX1C-GFP+(图3F)。91.9%的细胞表达造血和内皮标志物(CD34+ RUNX1C-GFP+ SOX17-mCHERRY+,蓝色轮廓),因此CD34+ RUNX1C-GFP+细胞可能经历了EHT。此外,检测到与EHT相关的SOX17-mCHERRY+ CD45+和CD43+ CD34+细胞(S2)。从MPG收获后,在接下来的24小时内,静止培养中RUNX1C-GFP+的表达增加(图3E),这表明RUNX1C-GFP+在EHT后上调。免疫表型分析显示更多数量的RUNX1C-GFP+、SOX17-mCHERRY+和CD34+细胞,以及红细胞(CD71、GYPA)、骨髓(CD45)、巨核细胞(CD41+)和祖细胞(CD7+CD34+CD45+)。
S3:hPSC衍生的跳动心肌细胞的延时活细胞成像(图源:[1])
02 循环流动和剪切应力促进造血前体细胞发育
轨道振动系统培养为研究循环流动的影响提供了另一种模型。研究人员用平衡实验设计和因子分析来量化循环流和剪切应力对造血前体细胞的影响,使用小分子载体和固定培养分别作为SB/CHIR处理和轨道振动系统培养的对照。
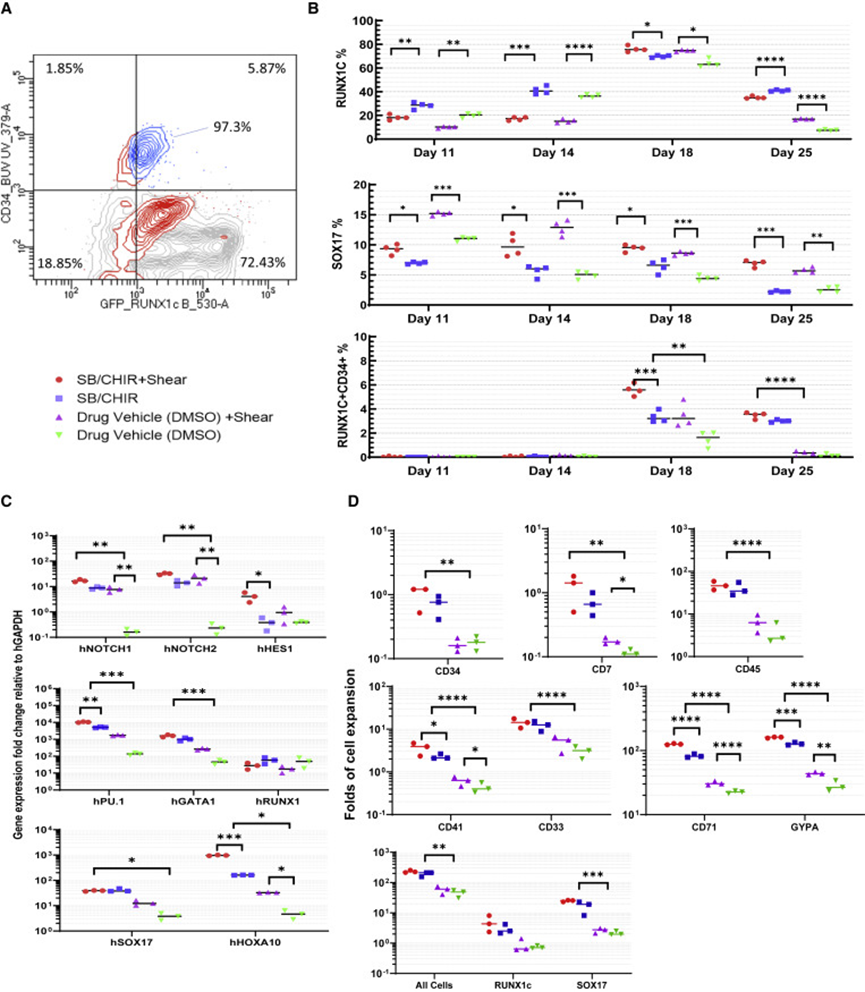
图4 使用轨道振动系统和SB/CHIR分化培养循环流量对造血发育的影响(图源:[1])
S4:使用微流体脉冲发生器对hPSC衍生的AGM培养进行延时活细胞成像(图源:[1])
对比发现,与小分子载体相比,轨道振动系统培养使NOTCH基因表达增加50倍以上,其水平与SB/CHIR固定培养的水平相似。此外,SB/CHIR处理导致CD34+细胞、CD7+造血前体细胞、白细胞、巨核细胞和多能祖细胞、骨髓和红细胞的多系潜能增加,带有轨道振动系统的SB/CHIR增加了来自纯化的CD34+细胞以及集落形成细胞的巨核细胞和红细胞的产量。微流控和轨道培养促进增殖性CD34+ RUNX1C-GFP+SOX17-mCHERRY+前体细胞的形成,这些前体细胞从SOX17+动脉样结构释放到人工循环中。
这项研究不仅揭示了造血干细胞前体是如何产生的,而且也揭示了可以通过人工诱导的方式来获得这些造血干细胞前体,这一研究成果意味着人类向使用诱导多能干细胞治疗某些难治性疾病又进了一步,未来或许可以实现消除对造血干细胞供体的需求这一目标。
该项研究的创新之处在于,研究团队开发了一种微流体培养系统以模拟原始胚胎的心脏跳动和血液循环,并通过制造的轨道振动系统验证了循环流动和剪切应力促进胚胎血液发育的假设。这些系统通过促进造血干细胞前体细胞的发育,进而增强了造血功能。
通讯作者Robert E. Nordon表示:“造血干细胞在胚胎中形成时,会在主动脉的主血管壁中形成。它们会从主动脉进入循环系统,然后进入肝脏形成血液。先形成主动脉,然后造血干细胞从主动脉进入循环,这是产生这些细胞所需的关键步骤。我们已经证明,可以产生一种可以形成所有不同类型血细胞的细胞。它与主动脉内衬的细胞密切相关,我们知道它的起源是正确的,而且能够在实验室反应器中大量制造。”
第一作者Jingjing Li博士表示:“我们制作了一个模拟心脏跳动和血液循环的设备,以及一个轨道振动系统,当血细胞通过设备或在盘子中移动时,它会产生剪切应力或摩擦力。这些系统促进了前体造血干细胞的发展,这些前体造血干细胞可以分化成各种血液成分如白细胞、红细胞、血小板等。用于移植的造血干细胞需要与患者组织类型相同的供体,从多能干细胞系制造血液干细胞将解决这个问题,无需组织匹配的供体提供充足的供应来治疗血癌或遗传疾病。我们正在努力使用生物反应器扩大这些细胞的生产规模。”
参考资料:
[1]Li J, Lao O, Bruveris FF, et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Rep. 2022 Sep 13;40(11):111339. doi: 10.1016/j.celrep.2022.111339. PMID: 36103836.