导语:衰老发生在世间万物的每分每秒。一直以来,科学家尝试从根源理论与机制出发,解码人类生命的衰老奥秘。那么,人体究竟是从哪一个年龄段开始经历断崖式衰老?近日,有研究指出答案是70岁,因为身处这个年龄段的人,其造血功能会急剧减弱,导致细胞再生能力下降、血细胞数量减少以及免疫力显著降低。原来“人生七十古来稀”真的有科学依据!
2022年6月1日,英国韦尔科姆基金会桑格研究所(Wellcome Sanger Institute)与Wellcome-MRC剑桥干细胞研究所联合在Nature发表题为“Clonal dynamics of haematopoiesis across the human lifespan”的研究论文。该研究揭示了人类造血干细胞随机体衰老的改变,指出70岁后人类造血功能急速下降或是由“血液干细胞中缓慢积累的遗传突变”造成,这一新理论为治疗衰老相关疾病及减慢衰老进程提供了新的见解。

图1 研究成果(图源:[1])
为探究衰老加速的具体机制,研究者分析了10名年龄界于0-81岁(涵盖新生儿到老年人)的人类受试者,对他/她们体内的3579个造血干细胞进行了全基因组测序,并确定了每个细胞中包含的所有体细胞变异。基于这些测序数据,研究人员对人体内血液干细胞的发育过程进行完整推演,制作出造血干细胞的“家谱”,首次客观呈现了造血血细胞之间的关系以及这些关系在人类一生中是如何变化的。
通过这些家谱,研究人员发现:
■ 数据显示,出生后造血干细胞或多能祖细胞平均每年累积17个突变,端粒长度会随着年龄增长而稳步下降,在成年后每年平均损耗30.8个碱基对。以18岁成年来计算,在经历了52年后,古稀之年的老人造血干细胞共积累了近900个突变,端粒共损失了1601.6个碱基对;
■ 人类在70岁之后,体内造血干细胞的群体结构及分化模式会大幅转变。即,人到了70岁之后,体内的造血干细胞分化出现“断崖式”下滑,人体产生的造血干细胞从原本65岁内2万~20万个下降为70岁以上的10~20个(图2)。
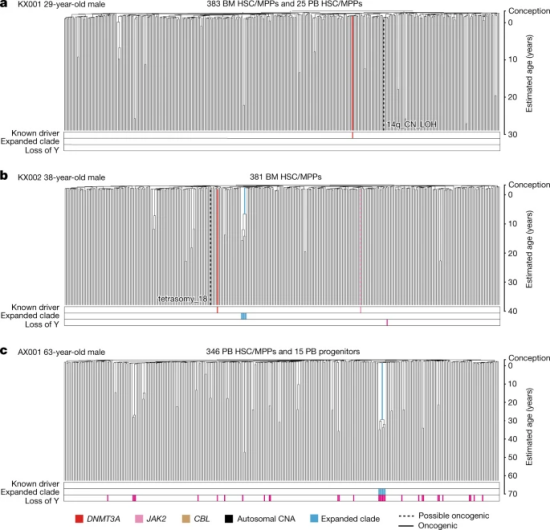
图2 三名老年成年供体的干细胞/多能造血祖细胞的系统发育过程(图源:[1])
上述结果揭示了不同血液干细胞间的关系,这些“高活性”干细胞多存在突变的情况,可导致老年人血细胞群体多样性不可逆转地减少,扰乱正常功能性成熟血细胞的产生,最终诱发多种与衰老相关的疾病。可见,70岁确实是人体极速衰老的一个关键分水岭。
这些发现促使研究小组提出了一个模型,其中与年龄相关的血液生成变化来自体细胞突变,导致“自私”干细胞在老年人的骨髓中占主导地位。这一模型不但可以阐明人类在70岁后血细胞群体多样性降低的缘由,而且由于每个个体中占主导地位的克隆干细胞种类不一定相同,该模型还能表明老年人患各类疾病的概率及特征的不同。
该研究首席研究员Emily Mitchell博士表示,“我们的研究结果表明,由于积极选择具有驱动突变且生长较快的克隆体,人类造血干细胞的多样性优势会随着年龄的增长而逐渐丧失。慢性炎症、吸烟、感染和化疗等因素会导致具有癌症驱动突变的克隆的早期生长,我们预测,这些可能也是与衰老相关血液干细胞多样性下降的相关因素。”
题图来源:站酷网,仅用于学术交流。
撰文|露娜
排版|文竞择
参考资料:
[1]Mitchell E, Spencer Chapman M, et al. Clonal dynamics of haematopoiesis across the human lifespan. Nature. 2022 Jun;606(7913):343-350. doi: 10.1038/s41586-022-04786-y. Epub 2022 Jun 1. PMID: 35650442; PMCID: PMC9177428.