
11月25日,初冬乍寒,生物探索“BioShare”分享交友会再一次在大家的期待中如约举办。秉承之前6期的“着眼医药创新、分享前沿技术”的主题,第七期活动以“依赖于人源化小鼠的肿瘤免疫疗法临床前评价方法介绍”为焦点,针对当下最热门的肿瘤免疫疗法,对其中关键的临床前评价方法展开论述和探讨。
主题报告:2位“一线大咖”的技术分享
孙瑞林博士:基因工程人源化小鼠模型的制备及在肿瘤免疫治疗中的应用

第一位演讲嘉宾是来自于上海南方模式生物科技股份有限公司的模型研发部经理孙瑞林博士。孙博士在过去5年间,带领团队完成了1200余种基因修饰小鼠模型的制备,在小鼠基因修饰技术、小鼠基因调控研究方面具有丰富的经验。
报告之初,孙博士深入浅出地介绍了肿瘤免疫治疗的现状。他表示,肿瘤免疫治疗在近几年取得了飞速发展,已经成为治疗肿瘤的第四代常规治疗方法。该领域包括肿瘤疫苗、非特异型细胞因子治疗、细胞治疗以及免疫检查点抑制剂4个大方面。
其中,免疫检查点抑制剂是肿瘤治疗和新药研发的有力主角,包括PD-1、PD-L1和CTLA4等在内的检查点抑制剂都展现出卓越的持久应答能力。它们以“刹车”机制启动免疫系统靶向肿瘤细胞。但是,正因为这类疗法的作用原理是基于免疫系统,所以在常规肿瘤疗法的研发及评价平台上无法进行验证,这意味着我们需要构建一套迅速准确、系统有效的肿瘤免疫疗法临床前评价方法。
孙博士强调,临床前,免疫治疗药物的评估模型需要满足3个条件:具备正常的免疫系统;能够成瘤;能够表达人类免疫检查点分子。
那么,如何构建人源化小鼠模型?孙博士介绍说有两种方法。第一种是将人造血干细胞移植到免疫缺陷小鼠体内,使其重建人类免疫系统。第二种是构建转基因小鼠,使其表达人类基因。其中,基因工程小鼠制备过程中,首先需要考虑试验目的,涉及怎样的肿瘤模型,它意味着不同的小鼠背景需求。
紧接着,孙博士详细介绍了几种人源化策略,包括插入人源基因至小鼠基因ATG位点、替换整个外显子、人鼠共存等等,并对这些方法各自的利弊进行了细致分析。目前,孙博士团队已经针对PD-1、PD-L1和CTLA4等分子构建了人源化小鼠,并成功用于抗体药物筛选、药效评估和肿瘤治疗。
最后,孙博士还讲解了基因工程小鼠定制的方法,包括传统胚胎干细胞(ESC)打靶和人工核酸酶(Talen、Cas9)介导的基因修饰方法,基于这类方法可以针对不同的小鼠模型进行特定的基因编辑。
彭思颖博士:人源化小鼠模型在肿瘤免疫治疗评价中的应用

第二位嘉宾是北京艾德摩生物技术有限公司的联合创始人兼首席执行官彭思颖博士。如何基于动物模型评价肿瘤免疫治疗?这是彭博士报告的主线。她着重围绕“人源化免疫重建小鼠在肿瘤免疫疗法评价的应用”进行了分享。
患者来源的肿瘤异种移植PDX模型(patient derived xenograft model)是一种体内模型,主要是将病人的新鲜肿瘤组织简单处理后移植到免疫缺陷小鼠上,依靠小鼠提供的环境生长,保留原代肿瘤微环境和基本特性。彭博士强调,实际上鉴于肿瘤异质性以及本身就很复杂的特点,动物模型构建过程中会遇到很多问题,涉及3个主要因素:肿瘤组织、细胞的提取、肿瘤微环境因素(免疫组织和间质细胞)和免疫系统。
随后,彭博士带大家回顾了免疫缺陷型小鼠的发展历程,从无胸腺裸鼠(T细胞功能缺陷)、T细胞和B细胞联合免疫缺陷小鼠(SCID或者Rag1/2)到多联免疫缺陷型小鼠(T细胞、B细胞和Nk细胞功能缺陷,NOG或者NSG)。她强调,动物模型的选择和重建对后续试验的开展至关重要。
如何在免疫缺陷型动物上将人的系统更多地参与,使其跟患者的临床表现更为接近?这就需要免疫系统更完善的人源化小鼠模型。彭博士表示,可以将造血干细胞(HSCs)移植到免疫缺陷小鼠体内,使其重建人免疫系统。在此基础上移植人源肿瘤组织,获得肿瘤免疫双人源化小鼠模型(Ideal-Immune Model)。
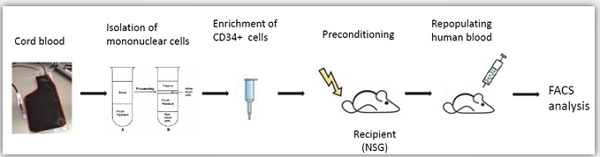
Hu-CD34 NSG小鼠模型构建流程图
这一模型能够真实模拟人免疫系统与肿瘤相互作用的过程,可用于临床前评价肿瘤免疫疗法的有效性和安全性以及放化疗、靶向药物的评价,例如免疫检查点抑制剂、CAR-T疗法、溶瘤病毒、肿瘤疫苗等等。
对于CAR-T疗法,彭博士表示:“从我们这边的研究评价结果来看,我对CAR-T的临床治疗应用很有信心。肿瘤异质性是肿瘤治疗中存在的最大障碍,每个肿瘤都有各自不同的一些靶点,肿瘤的靶点治疗特异性很强,消灭一个靶点,又会有新的靶点,而找出每个肿瘤的靶点难度系数很高。目前对于解决肿瘤靶点的问题,我认为采用混合靶(多靶点)是首选,现在已经有很多药物是针对多靶点的;其次是药物的联合使用,例如PD-1可以和化疗药等进行联合使用。”
CAR-T在急性血液肿瘤的临床试验中已经取得了显著的疗效,被认为是最有前景的肿瘤治疗方式之一。近期,它开始被用于实体瘤的临床试验。彭博士建议,在CAR-T疗法进入临床之前,使用人源性肿瘤组织异种移植(PDX)小鼠模型作为肿瘤患者的替身进行相关验证,因为PDX模型高度保持了肿瘤组织的异质性、分化程度、形态特征以及分子特性。
除了药效评价,CAR-T疗法还需要注意安全性问题。彭博士解释说:“借助肿瘤移植小鼠模型,通过监测小鼠体重变化、肿瘤生长情况、CAR-T细胞分布、细胞因子浓度等指标,可以评估其安全性。”
围炉对话:实践、探索中,我们遇到了哪些问题?

当干货满满的报告结束之后,现场的生物探索会员们围绕模型制备、药效评估等实际操作过程遇到的技术问题与嘉宾进行了“零距离”的交流互动。
考虑到篇幅有限,小编挑选了其中一些代表性问题,“重现”嘉宾们精彩的答疑解惑过程。(PS:想知道更多的内容,欢迎大家光临BioShare之后的活动现场哦。)
Q:如何增加PDX小鼠模型的成瘤率?
嘉宾:鉴于PDX模型的异质性相对较强,所以可以多传代培养,使其成瘤趋向稳定。此外,还可以将人源肿瘤组织处理成细小的块状,类似于单细胞的状态。
Q:Hu-NSG模型构建过程中,CD34+细胞以及人源化肿瘤组织移植的时间点如何把控?
嘉宾:CD34+细胞一定是先移植,因为人免疫系统在小鼠体内重建大约需要12—16周的时间,之后再移植肿瘤组织。只有免疫细胞充分浸润到肿瘤组织中才能用于药效评价。具体的时间把控应该依据试验需求而设定。
Q:选择多大的小鼠用于肿瘤免疫人源化模型构建?
嘉宾:造血干细胞移植之前需要对小鼠进行处理,使其本身的造血干细胞清除干净。我们选择新生2天的小鼠,直接通过静脉注射造血干细胞,它不需要进行前期处理,但是操作要求较高。
Q:双人源化小鼠模型如何验证,例如PD-1/CTLA4?
嘉宾:理论上,双人源化的策略与单人源化一样。我们可以通过PD-1和CTLA4分子的体内表达情况进行验证,并不是从药效结果上对模型进行评价。
活动最后,二位同时表示,人源化免疫重建小鼠可以成为推进新药研发的有力工具,从而加速国内创新药物和新型疗法的诞生。他们对肿瘤免疫疗法表达了极大的肯定,并认为它是唯一有望彻底攻克癌症的疗法,有望填补手术、放化疗所不能企及的空白。







