这一年多一直在关注这一领域,但一直没有系统的去看,这段时间整理了一下这方面的资料,写了出来让大家看看,分析中的图表多是我根据一些文献资料、专业信息网站(clinicaltrials、生物谷、生物探索等)、各公司官网、券商研报等整理的,码字辛苦,不喜勿喷。
1.特异性免疫原理:
一直在犹豫要不要加上这部分,最终还是决定加上了最基本的原理部分,因为我觉得,理解这些最基本的原理对于理解后续的东西至关重要,不只是CAR-T,对于PD-1/PD-L1抑制剂及NK、CIK/DC-CIK的理解也一样。
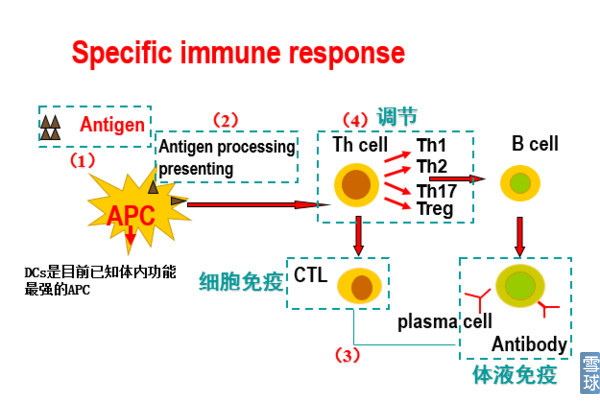
过程:抗原的识别——APC抗原加工与呈递——特异性免疫
细胞免疫由细胞毒性T细胞(CTL)介导(即我们通常理解的T细胞,还有一类是辅助性T细胞,即上图中的Th cell,参与体液免疫)。
T细胞的活化需要共刺激信号
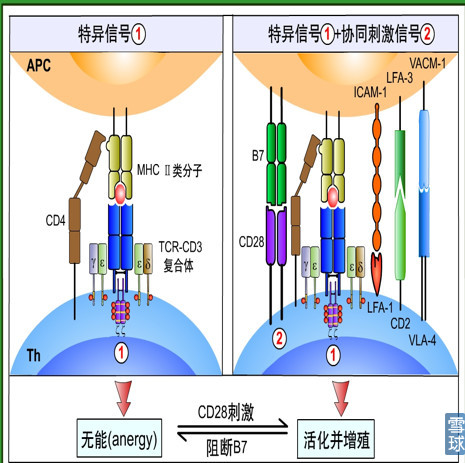
即T细胞的活化不但需要特异性的识别抗原还需要有协同刺激信号。在肿瘤中:(1)肿瘤细胞要有抗原递呈,会被 T 细胞受体识别(特异性信号)。(2)要有第二信号参与(如图中CD28参与),CD28也必须被活化。第一、第二信号都活化后,T细胞才可以杀伤肿瘤。
先说特异性识别信号:
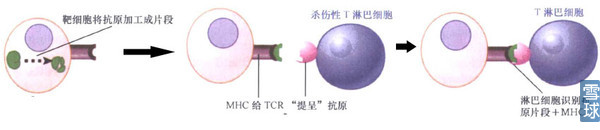
这一部分涉及三个方面:TCR,MHC,抗原加工呈递。
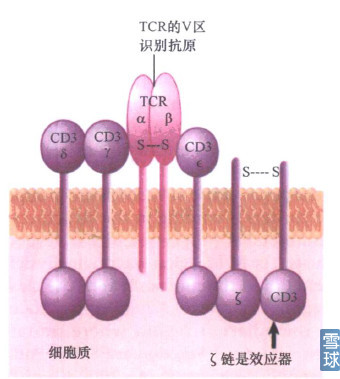
TCR,即T细胞表面受体,TCR与CD3蛋白复合体结合从而发挥作用。当与CD3相连的受体同抗原结合并被激活时,CD3就可参与信号从细胞表面到内部的转导。TCR可变区和抗原的相互作用会引发CD3复合体的ζ亚基激活T淋巴细胞应答。
TCR-CD3复合体:
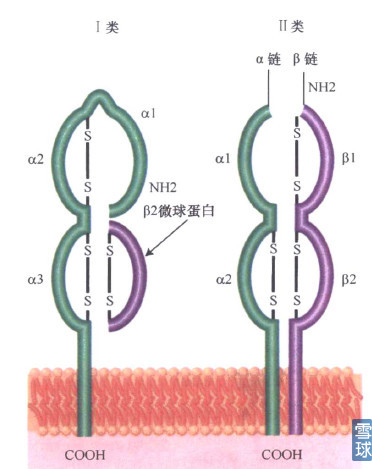
MHC,说MHC可能很多人不知道,但HLA很多人都知道,比如去医院体检发现HLA-B27阳性,医生就会提示可能得了强直性脊柱炎,HLA就是受控于称作人类主要组织相容性复合体(MHC)的基因簇。总的来说主要分为两类:MHC I,MHC II。
MHC I:存在于每个细胞表面,人类I类基因编码经典的移植抗原HIA-A、HIA-B和HLA-C,内源性抗原的递呈分子。
MHC II:存在于B淋巴细胞、T淋巴细胞、巨噬细胞及 DC细胞中。MHC II类蛋白参与关键的细胞之间的抗原提呈和交流,这是诱导特异免疫应答所必需的。
两类MHC结构:
再说共刺激信号:
根据分子结构分类:1、免疫球蛋白超家族2、TNF/TNFR 家族3、Tim家族和SLAM家族
按照功能分类:1、正性共刺激分子 2、负性共刺激分子
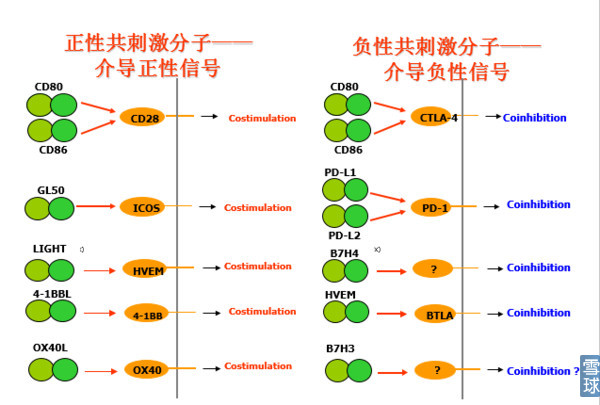
共刺激(正性共刺激)分子/协同刺激分子 → 增强TCR信号介导的免疫应答
共抑制(负性共刺激)分子/协同抑制分子 → 抑制TCR信号介导的免疫应答
肿瘤也是从如上两点成功实现了免疫逃逸:(1)肿瘤细胞抗原递呈的机制会被下调甚至丢失该能力(HLA 阴性),导致 T 细胞无法识别肿瘤细胞。(2)很多肿瘤细胞异常高表达PD-L1 分子,使 T 细胞表面 PD-1 分子被活化,会导致T细胞功能的耗竭、甚至T细胞的死亡。当然,除了这些主要的免疫逃逸机理外,还有其他机制也在帮助肿瘤细胞的免疫逃逸。
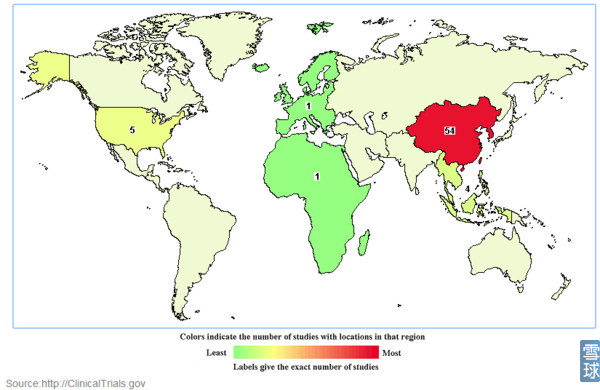
这也是包括细胞因子诱导的杀伤细胞(cytokine-induced killer cell, CIK细胞)在内的T细胞过继性免疫治疗虽然在部分肿瘤的治疗中取得了一定的效果, 但在大多数肿瘤中疗效尚没有什么作用的原因(CIK,DC-CIK国外基本淘汰,国内却依然火热)。
全球CIK、DC-CIK登记临床试验分布:
2.CAR-T结构
现在做的比较多的二代CAR-T也是从如上2点克服肿瘤:自带识别肿瘤表面抗原的抗体,自带共刺激信号!
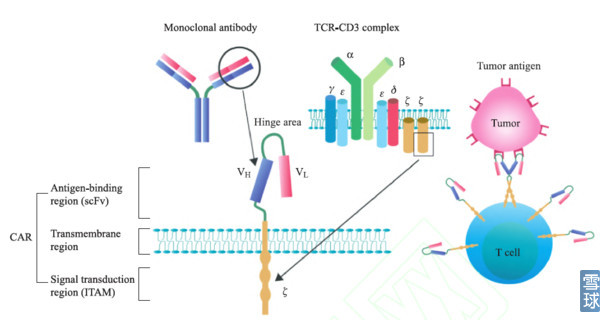
典型的CAR由胞外抗原结合区、跨膜区域和胞内信号转导区组成。其中抗原结合区由来源于单克隆抗体的轻链 (vl) 和重链 (vh) 组成, 中间由带韧性的铰链区连接形成单链抗体 (single chain fragment variable. scfv)。CAR结构里的第一个关键部位是识别肿瘤抗原的单链抗体,它能识别肿瘤特异性抗原,即所说的靶点,比如识别CD19,EGFR等,而不是需要加工递呈出来的抗原多肽,因此这样的结构解决了两大问题:靶向性问题和绕开抗原递呈的问题,肿瘤患者就算把HLA丢失或抗原递呈能力下调也没关系。
细胞内信号转到区主要为免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs, ITAM, 通常为CD3ζ或FcεRIγ)以及共刺激信号,用的最多的为CD3ζ也是天然的TCR活化序列,共刺激信号使得CAR-T细胞在体内存活时间非常长。
几代CAR-T的区别在于细胞内信号转到区连入了不同的正向共刺激信号:
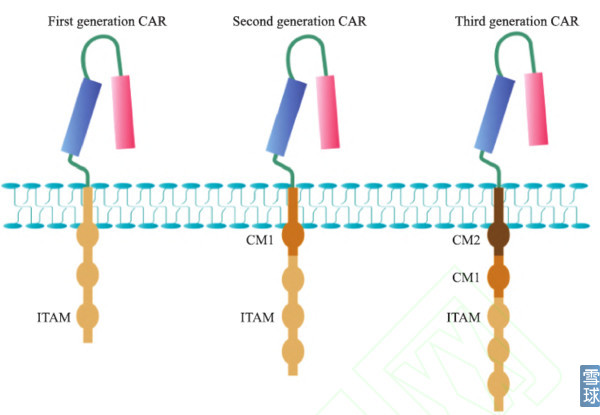
第一代CAR(左)由单链抗体通过跨膜区域与胞内信号传导区(ITAM)相连, ITAM通常为CD3ζ或FcεRIγ; 第二代CAR(中)的胞内信号转导区引入了共刺激分子CM1, 主要为CD28分子; 第三代CAR(右)引入了双共刺激分子(CM1和CM2), 主要为CD28分子加上CD134或CD137。
早期的实验证明了CAR-T 的可行性,然而第一代CAR 只能引起短暂的T 细胞增殖和较低的细胞因子分泌,不能提供长时间的T 细胞扩增信号和持续的体内抗肿瘤效应。依照T 细胞活化的双信号学说,T 细胞的激活和增殖需要共刺激信号;第二代、第三代CAR 引入了共刺激分子信号序列,旨在提高T 细胞的细胞毒活性、增殖性与存活时间,促进细胞因子的释放。
到目前为止,已知最好的激活与共刺激结构区为CD-19CARs受体整合CD28或4-1BB信号区。基于CD28或4-1BB信号区改造的CAR-T细胞,二者都能够针对难治性B淋巴瘤显示出显著的完全缓解率。近期的研究数据显示基于CD28信号区嵌合受体能够敏锐的刺激出增殖反应并且提高效应因子的功能,而基于4-1BB信号区嵌合受体能够进一步诱导T细胞的增殖和富集。这些显著的动力学特征能够为进一步开发基于CAR-T技术的肿瘤免疫细胞治疗提供新的途径和方法,有望于解决其他种类的肿瘤。
3.全球CAR-T研发及临床试验登记情况:
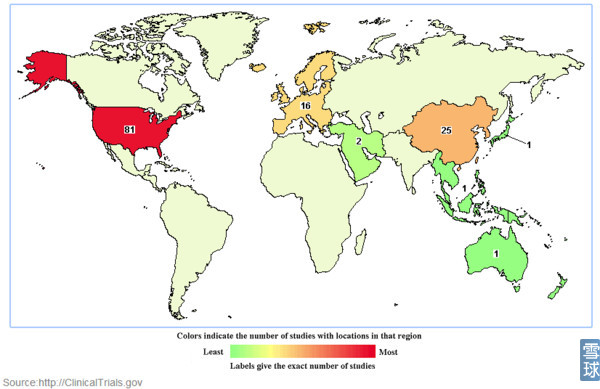
截止到2016年1月10日全球范围内进行的CAR-T约125项(受关键字影响不一定准确)。美国最多(81项),其次是中国(24项)。
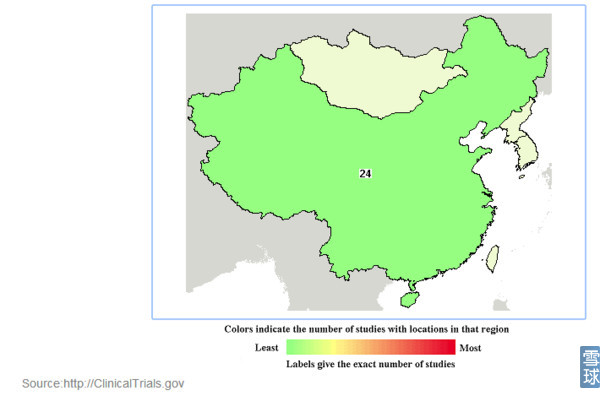
中国CAR-T临床试验登记列表:
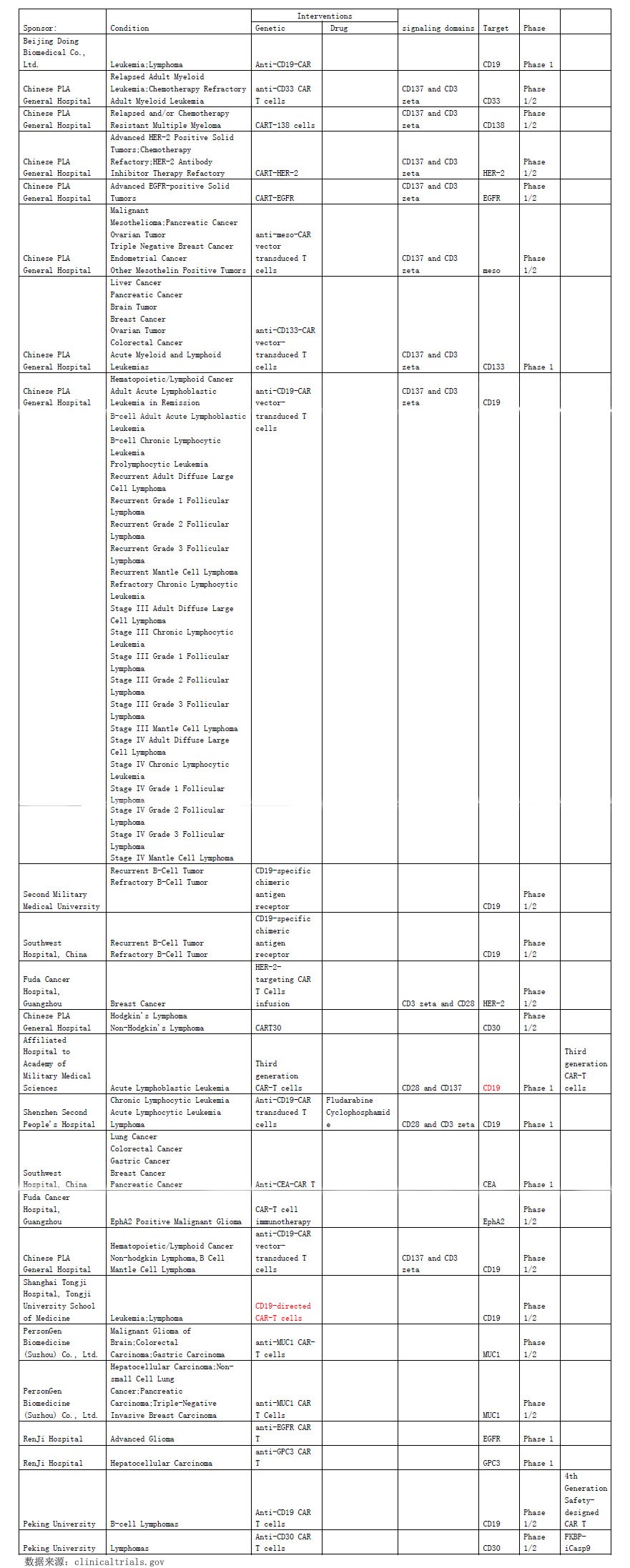
对比一下中美CAR-T情况:
1.靶点:
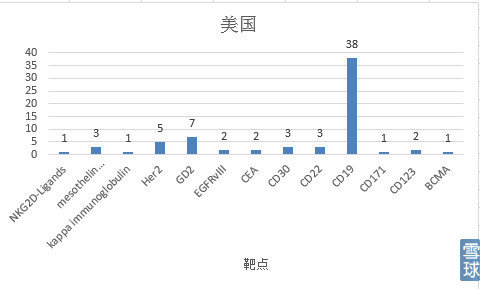
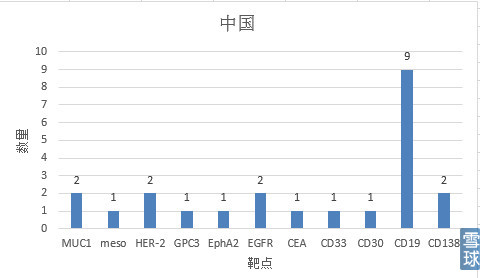
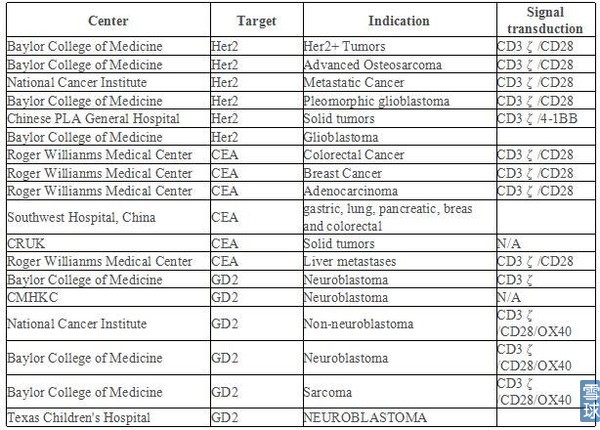
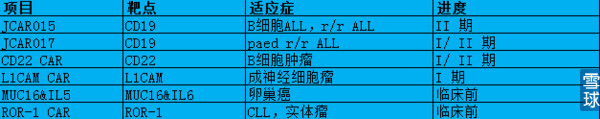
可以看到无论是中国还是美国,大多数针对重要组织不表达或相对可损耗组织表达的肿瘤相关抗原(tumor associated antigen, TAA)。其中, 以针对CD19、CD20和CD22为靶抗原的CAR-T细胞治疗B细胞恶性肿瘤研究得最多, 原因就是即便损伤了成熟B细胞, 也只是暂时的、可恢复的; 且缓解期血液肿瘤细胞数量级约为10的8至9次方, 而1 cm实体肿瘤其肿瘤细胞数就有约1×10的9次方。实体瘤肿瘤微环境的免疫抑制作用更强, 免疫细胞不易进入实体瘤内部, 也是CAR-T细胞目前主要治疗血液系统疾病的一重要原因。
CD19不但表达于所有正常的B细胞表面也表达于多数恶性增殖的B细胞表面。由于CD19在造血干细胞中不表达,使用抗CD19的CAR-T细胞进行治疗,其毒性也被限制于B细胞再生障碍性贫血。这种“是靶向/非肿瘤”毒性在治疗B细胞再生障碍性贫血中是可以忍受的。其余研究较多的靶点有Her2、GD2、CEA、mesothelin等。
比较有意思的是美国Celdara Medical, LLC的一项研究:Safety Study of Chimeric Antigen Receptor Modified T-cells Targeting NKG2D-Ligands,这项研究的靶点是广泛表达于多种肿瘤细胞表面的NKG2D配体,目的是为了研究出一种“通用”的CAR的。
2.单位
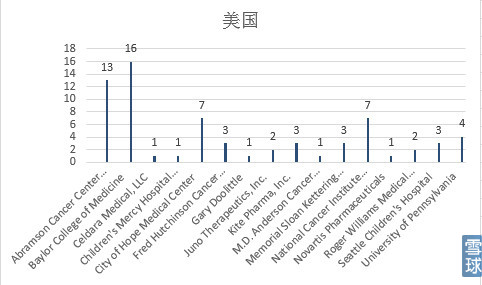
可以看到University of Pennsylvania(Abramson Cancer Center of the University of Pennsylvania 13项,University of Pennsylvania 4项)17项最多,其次是Baylor College of Medicine。公司方面是诺华、Juno、Kite三家。
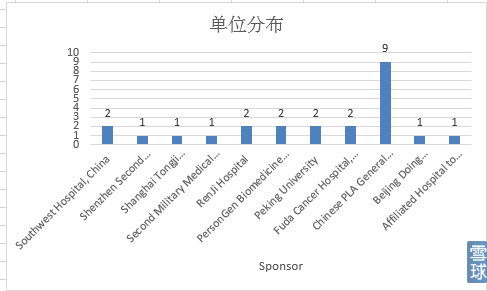
国内可以看到最多的是301医院,公司方面是PersonGen Biomedicine(博生吉)和Beijing Doing Biomedical。
另外还有几个有意思的结果是:为了解决存续时间问题美国有很多EBV、CMV特异性CAR-T(约7项);对于共刺激型号选择方面虽然全球范围内最多的是CD28做为共刺激,Abramson Cancer Center of the University of Pennsylvania 和301医院都较多的选择4-1BB(CD137);北京大学肿瘤医院朱军教授的三项研究(与佛罗里达大学合作)全都是4代CAR-T,其中设计了一个FKBP-iCasp9的自杀基因;Baylor College of Medicine的一项以GD-2靶点的CAR是基因修饰的NK细胞并且是CD28、OX40双共刺激信号,不是T细胞,准确说是CAR-NK(3RD GENERATION GD2 SPECIFIC CHIMERIC ANTIGEN RECEPTOR TRANSDUCED AUTOLOGOUS NATURAL KILLER T-CELLS FOR NEUROBLASTOMA (GINAKIT))。
4.目前存在的困难与问题:
1. 是靶向/非肿瘤
理想的目标抗原只在肿瘤细胞表达并且对肿瘤细胞的存活有重要意义。但目前已知的肿瘤特异性抗原(tumor specific antigen, TSA)较少, 除了少数CAR-T试验针对前列腺特异性膜抗原(PSMA)和表皮生长因子受体Ⅲ(,EGFRvⅢ)等TSA外, 大多数针对重要组织不表达或相对可损耗组织表达的肿瘤相关抗原(tumor associated antigen, TAA),不幸的是表达的大多数TAA不具备肿瘤细胞限制性,从而导致“是靶向/非肿瘤”毒性的产生。
以目前应用广泛CD19靶点为例,这种抗原不但表达于所有正常的B细胞表面也表达于多数恶性增殖的B细胞表面。由于CD19在造血干细胞中不表达,使用抗CD19的CAR-T细胞进行治疗,其毒性也被限制于B细胞再生障碍性贫血,可通过补充丙种球蛋白来轻松处置,因此这种“是靶向/非肿瘤”毒性在治疗B细胞再生障碍性贫血中是可以忍受的。
在实体瘤中“是靶向/非肿瘤”毒性远非B细胞再生性贫血障碍那么简单。实体肿瘤上,CAR很可能因为没有归巢到肿瘤位置,而和靶点表达较少的正常细胞结合,杀死正常细胞,产生致命危险。一个结肠性转移的患者在接受消耗性化疗接连ERBB2靶向的T细胞过继5天后死亡。推测是由于肺部聚积了大量的改造的T细胞,它们识别肺上皮少量表达的ERBB2后引起了促炎症细胞因子的大量释放。促炎症细胞因子的释放引起了肺部毒性、多器官衰竭,进而导致病人的死亡。用表达CAIX的第一代CAR治疗肾细胞癌时,11例病人中有5例被报道发现了肝脏毒性。总结病因是改造后的靶向型T细胞可以识别胆管上皮低水平表达的CAIX。
上述研究凸显了在相同时期与正常组织相区别的特异性靶向抗原的重要性。
目前的办法有:寻找肿瘤特异性更强的抗原,如神经胶质瘤中的EGFRvIII;设计的改进和T细胞的抗体识别区域亲和力,以较低的亲和性识别抗原高表达的肿瘤细胞, 而不攻击相同抗原低表达的正常细胞;双功能的CAR,其策略主要是让1 个T 细胞表达2 个不同的CAR,即使其中一个CAR 的抗原在正常组织中有少量表达,也可通过另一个CAR 来提高T 细胞的特异性。;自杀开关(如北京大学两项研究,引入iCasp9自杀基因)。
2. 炎症因子风暴
促炎症细胞因子的增多是一个过继后T细胞功能的标志。CLL(慢性淋巴细胞性白血病)病人外周血和骨髓中的促炎症细胞因子的增多与CAR改造T细胞的扩增协同出现。携有较大残留病灶负荷的患者接受CAR-T治疗产生严重细胞因子释放综合征的风险更高。细胞因子释放综合征(CRS)没有标准治疗方式,目前用类固醇进行处置,或最近使用的IL-6单克隆抗体tocilizumab来处置。
3. 难规模化
CAR-T的制备流程:
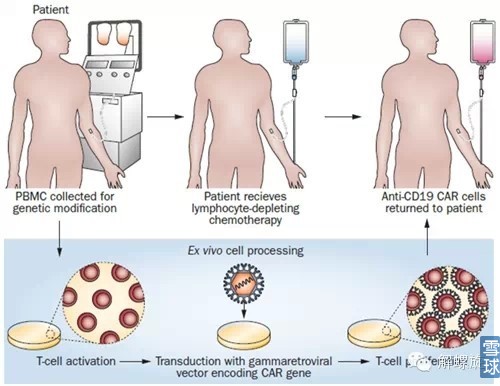
经典的CAR-T的治疗过程在14天完成,从采血到回输。CAR-T细胞的制备时间是很长的,经常会出现病人要等1、2个月才能来治疗。在病人入院前一个月、甚至二个月就要开始做准备工作。在CAR的制备中,每个环节都很重要,美国的CAR效果比较好就是因为各个细节都尽可能做到优化。比如,如果我们制备出来的T细胞都是晚期效应的T细胞,虽然其杀伤能力最强,但在体内存活时间短,那么效果会大打折扣。然而最希望看到的是中心记忆T细胞,兼顾细胞毒的杀伤能力与在体内长期存在的能力。
制备的复杂性及个性化的结果就是周期长、难以标准化、成本高、管理难,制备难,市场扩张也很难。
目前的解决办法:构建通用的CAR-T,现在很多的CAR-T公司与基因编辑公司联姻就基于此(也因基于把CAR-T细胞里面的PD-1敲除掉),例如Cellectis通过敲掉T细胞的TCR及CD52,构建的异体T细胞,若能按最优化条件来做,1个正常人提供的T细胞可以供给1000个病人,成本会大幅下降。
4. 插入突变
CAR-T技术是在T细胞中插入一段外源DNA片段, 理论上说其结构已被破坏, 存在一定的致瘤风险。虽然目前并没有关于基因改造T细胞致瘤性的报道, 但是研究者还是一直在关注此问题, 也在不断通过优化载体类型和转染方式来降低插入突变的风险。
另外,由于目前的CAR大多基于鼠源抗体的scFV进行设计,这种异源模型可能会引起不希望出现的宿主抗CAR反应。这种针对CAR的反应已有报道。其中一个阻止这种反应的策略是将scFV片段人源化或利用人源抗体设计CAR。
5. 实体难起效
目前大家都在想办法利用CAR-T攻克一些实体瘤,但到现在为止,效果没那么理想。
目前的实体瘤临床研究项目:
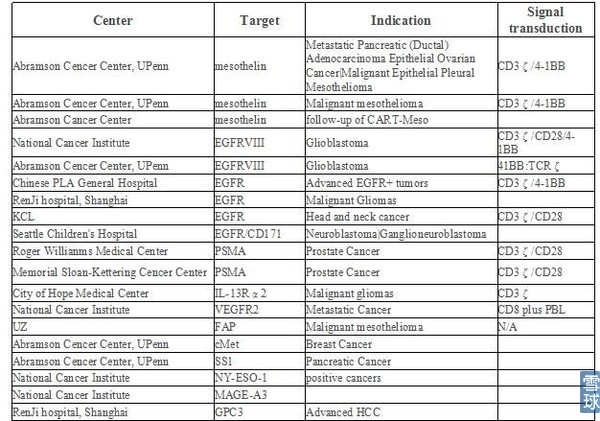
最成功的CD19-CART,其治疗慢性淋巴性白血病的效果就低于急性淋巴性,实体肿瘤的效果差得就更远。客观分析实体肿瘤疗效不好的原因,问题出在实体肿瘤在慢性发展过程中,在体内构成一个刀*不入的微环境。这里面有浸润性的调节性T细胞(Treg细胞)、肿瘤相关巨噬细胞、PD-L高表达、抑制性细胞因子(比如白介素10、TGFb),这一系列因素把肿瘤保护得非常严密。静脉回输CAR-T细胞后,没几个T细胞能归巢到肿瘤位置。宾大的5例实体肿瘤临床数据报道后,还拖累了Juon和Kite的股价。
可能的解决办法是第四代的CAR。第四代CAR让T在工作时,会共表达一个白介素12因子。在CAR上,让白介素12在靶向位置局部表达,可以改善免疫治疗微环境。把附近的NK细胞召唤过来并激活,下调Treg细胞的数目,并把浸润的T细胞功能唤醒。
5.投资标的:
这两年在肿瘤免疫方面的交易合作特别多,2015年的部分如下:
美股:
诺华目前在该领域处于领先地位,其临床试验中有开发用于白血病、淋巴瘤、间皮瘤和胰腺癌的实验性产品。2014 年7 月,其CTL019 收获了FDA的突破性疗法认定。此外就是新贵Juno Therapeutics, JCAR015也于2014 年底获得了FDA 的突破性疗法认定。除此之外, Kite Pharma、Bluebird bio、Celgene、辉瑞以及强生也纷纷以资本并购或合作方式进入该领域。此外西比曼生物科技(上海)于2014年6月18日正式在美国纳斯达克挂牌上市,CBMG主要和301医院的韩为东教授合作。
1. 诺华
诺华的合作方是在CAR-T疗法中的领头羊宾夕法尼亚大学,2012年与宾夕法尼亚大学合作开发基于CD19 靶点的CAR-T技术,斥资2000 万美元新建实验室,2014年又斥资2000 万美元在宾大医学院建立一个细胞疗法研究中心,成为全球首个综合性CAR-T细胞疗法开发中心。2015年初与Intellia Therapeutics展开一项长达5 年的研发合作计划,主要致力于加速发展CRISPR/Cas9 技术在CAR-T细胞治疗和造血干细胞中的应用。
2014 年7 月,其CTL019 收获了FDA的突破性疗法认定,药物研发完毕后享受一切FDA 审批的绿色通道。在ASH2015年会公布的结果目前规模最大的CAR-T疗法治疗儿童复发或难治性ALL的临床数据。在病患数量基本翻倍的情况下,与2014年公布的I期数据(完全缓解率92%,n=36/39)几乎完全相同, CTL019通过FDA审批上市只是时间问题。
研发管线:

2.Juno Therapeutics,Juno Therapeutics(JUNO)是由Fred Hutch、Memorial Sloan Kettering 癌症中心、西雅图儿童中心三家医学机构组建的医学研究公司
Juno 除了开发CAR-T ,也在开发TCRT,研产品,JCAR015在2014 年了FDA 的突破性疗法认定。
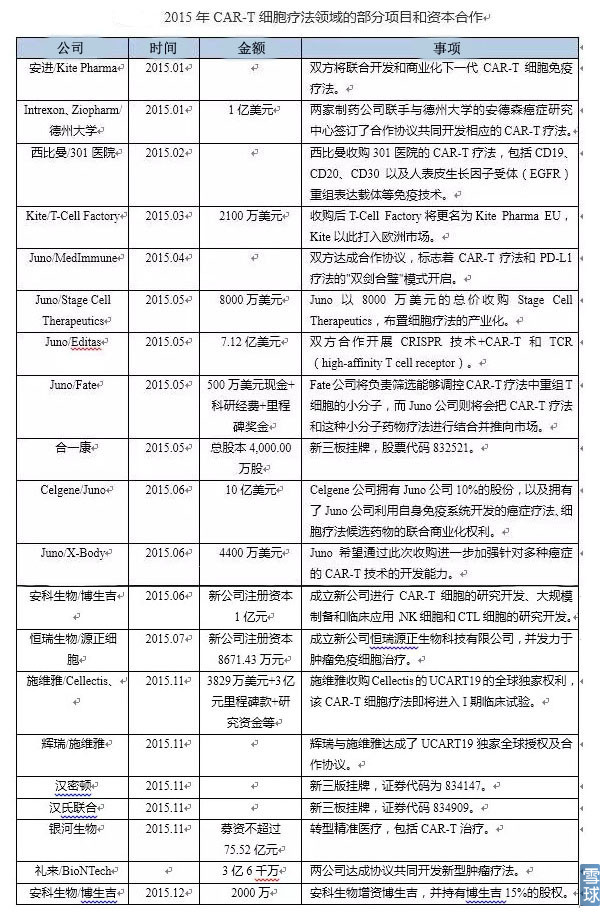
研发管线:
3.Kite Pharma,Kite Pharma.(KITE)与美国国家癌症研究所(NCI)、美国国立卫生研究院(NIH)建立了广泛的合作关系,公司是全球唯一拥有美国国立卫生研究院(NIH)许可的药物公司。值得注意是Kite Pharma也做TCR-T方面研究开发。目前CD19 CAR 和KTE-C19 进展最快,分别处于临床2/3 期和1 期。2015年 12月7日ASH2015上,KITE公布了其CAR-T疗法KTE-C19-101(ZUMA-1)针对难治性恶性NHL的I期临床数据。7例DLBCL患者中4例完全缓解,1例部分缓解,总应答率为71%(5/7)。同时,KITE公司KTE-C19治疗NHL在II期临床试验阶段被FDA授予突破性治疗药物资格。如果进展顺利,该产品有望成为治疗DL-BCL 的三种疗法之一。
研发管线:

CAR-T领域三个大玩家的临床效果怎么样呢?如下是进展比较快的几个项目的数据:
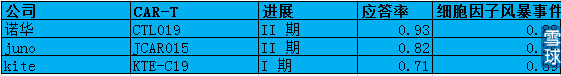
4.CBMG,CBMG的背后是301医院,于2015年2月收购301医院 CAR-T疗法,获得CD19,CD20,CD30,EGFR等CAR-T技术。2015年9月,西比曼公布了其针对实体瘤EGFR靶点的CAR-T疗法“CBM-EGFR.1”的I期临床数据,在多种类型实体瘤上取得了应答,研发进度处于国际领先。2015年10月26日,西比曼公布了其针对晚期B细胞NHL的CAR-T疗法IIa期临床研究进展,靶点为CD20,与韩为东教授合作。10例可评估患者中有5例完全缓解,3例部分缓解,2例病情稳定,总应答率达到80%(8/10),完全缓解率50%(5/10),持续完全缓解时间4~>11个月。
5.Cellectis,Cellectis是异体T细胞治疗平台领跑者,其通过TALEN 技术敲除了CAR-T细胞的TCR和CD52基因,在达到消除组织相容性问题。2015年11月6日,Cellectis的异体CAR-T疗法向前迈出重要一步。一例11个月大难治性白血病女婴使用该公司UCART19疗法2个月后获得完全缓解,Cellectis股价当天上涨超过20%。2015年12月7日ASH2015年会上,Cellectis详细展示了这一治疗过程。如果异体CAR-T最终可行,单例治疗价格可能下降到5-10万美金,生产效率也会大幅提升,CAR-T疗法领域也将迎来变革。
异体T细胞是CAR-T制备难题的一个很好的解决办法,而解决这一问题最好的办法就是基因编辑(关于基因编辑后续有时间再聊)。所以各大巨头都在寻求基因编辑公司的合作。

A股•
A股直接做CAR-T的上市公司还没有,正真介入的主要是恒瑞和安科(香雪等不玩CIK后玩TCR-T的、NK的未统计)。
恒瑞医药在今年与深圳源正细胞合作成立恒瑞源正生物科技有限公司,进入此领域,但目前还貌似没有CAR-T产品进入临床。
安科生物也通过与博生吉合作进入了此领域。2015年11月,博生吉注册了两项CAR-T研究,分别与武警浙江总队医院(招募20人)以及武警安徽总队医院(招募10人)合作。针对实体瘤MUC1靶点,适应症包括肝细胞癌、非小细胞肺癌、胰腺癌和三阴性乳腺癌等。
风险提示:生物医药研发风险极高,周期也很长,肿瘤免疫是目前全球极度热门领域,国内很多公司打着肿瘤免疫疗法概念忽悠投资者,谨慎投资。







