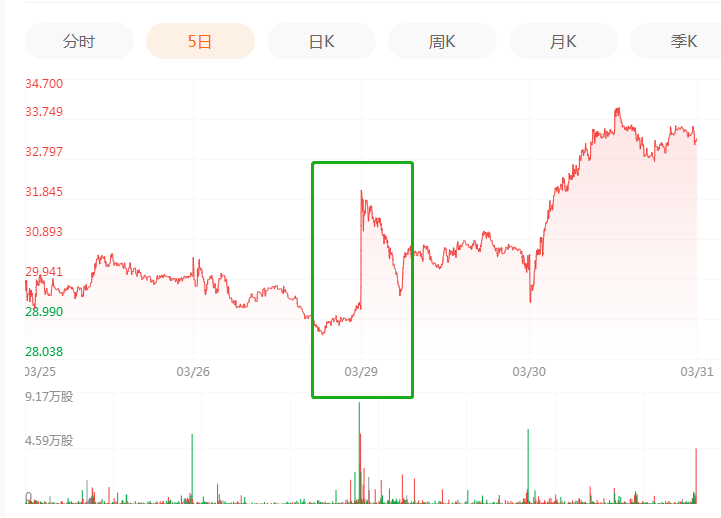
当地时间3月29日,在积极配合美国食品药品监督管理局(FDA)的审查后,uniQure公司宣布,旗下B型血友病(hemophilia B)基因疗法Etranacogene dezaparvovec(AMT-061)“极不可能(highly unlikely)”导致患者出现肝癌,结果公布后,uniQure公司股价随之上涨近8%。
血友病是一种由于凝血因子IX缺失或缺陷引起的遗传性出血性疾病,主要分为A、B两种类型,前者为凝血因子Ⅷ(FⅧ)缺乏,后者为凝血因子Ⅸ(FⅨ)缺乏。据统计,全球有超过112.5万名男性患有这种遗传性出血性疾病,新生男婴的患病率大约为1:5000。在过去的几十年中,血友病的临床治疗已获得了显著改善,随着精准医学领域的迅速发展,基因疗法走进了大众的视野。
AMT-061是uniQure公司继AMT-060后的一款基于腺相关病毒5(AAV-5)的基因疗法,该疗法装载人FIX基因突变体(FIX-Padua),突变后的Padua hFIX能将IX因子的活性提高8-9倍。此前,AMT-061曾被美国食品药品监督管理局(FDA)授予的突破性疗法称号,以及欧洲药品管理局(EMA)授予的优先药品(PRIME)称号。

去年11月份,uniQure公司公布了一项名为“HOPE-B”的AMT-061关键性III期临床试验结果,该试验共招募了54例患者,经单次静脉输注2x10 13 gc/kg 剂量的AMT-061药物 26周后,患者的FIX活性从正常值的≤2%迅速提高至37.2%。值得一提的是,该临床数据是来自B型血友病基因疗法Ⅲ期临床的首个数据集,也是迄今为止报告的接受一种单基因疗法治疗的最大数据集。
一个月后,uniQure公司宣布暂停其治疗B型血友病的III期临床试验,原因是AMT-061的临床实验中报告了一例肝癌患者病例,由于无法确定该患者的症状是否与基因疗法“Etranacogene dezaparvovec”有关,因此美国食品药品监督管理局(FDA)决定叫停该临床试验,调查患者出现肝癌的具体原因。
2021年3月29日,在经历近4个月的调查后,uniQure公司宣布其AMT-061基因疗法“极不可能(very unlikely)”导致接受治疗的B型血友病患者出现肺癌症状。调查结果显示,患者样本组织中的AAV载体整合事件极为罕见,仅占到肿瘤组织样品中的0.027%。此外,据了解,该患者曾患有乙肝、丙肝和非酒精脂肪肝,这些疾病都有可能是癌症的驱动因素。
今年2月初,蓝鸟生物也发生过此类乌龙事件。由于一名5年前接受镰状细胞病HGB-206基因治疗的患者被诊断患上急性髓细胞白血病(AML),蓝鸟生物(bluebird bio)宣布暂停临床试验。受此影响,蓝鸟生物股价大跌近38%。但在经过了近一个月的调查后,蓝鸟生物宣布其LentiGlobin基因疗法“极不可能(very unlikely)”导致接受治疗的镰状细胞病患者出现急性髓细胞白血病(AML)。

目前,uniQure公司正在准备与FDA洽谈,以恢复其之前暂停的针对B型血友病的临床试验。据悉,uniQure将在第二季度公布更多的Ⅲ期临床数据,继续推进血友病基因疗法未来上市的进程。
参考资料:
[1]https://www.fiercebiotech.com/biotech/uniqure-gene-therapy-highly-unlikely-to-liver-cancer-trigger