2022年1月7号,马里兰大学医学院UMMC心脏移植团队首次将基因改造的猪心脏移植到患有终末期心脏病的成年人体内。据悉,该患者名为David Bennett,是一名57岁的勤杂工,患有严重的心力衰竭和心律不齐,并已丧失人类心脏移植机会。这项世界第一例异种心脏移植手术历时9个小时,并取得良好结果。目前David Bennett已恢复自主呼吸,意识良好,但手术是否成功,仍需继续观察。
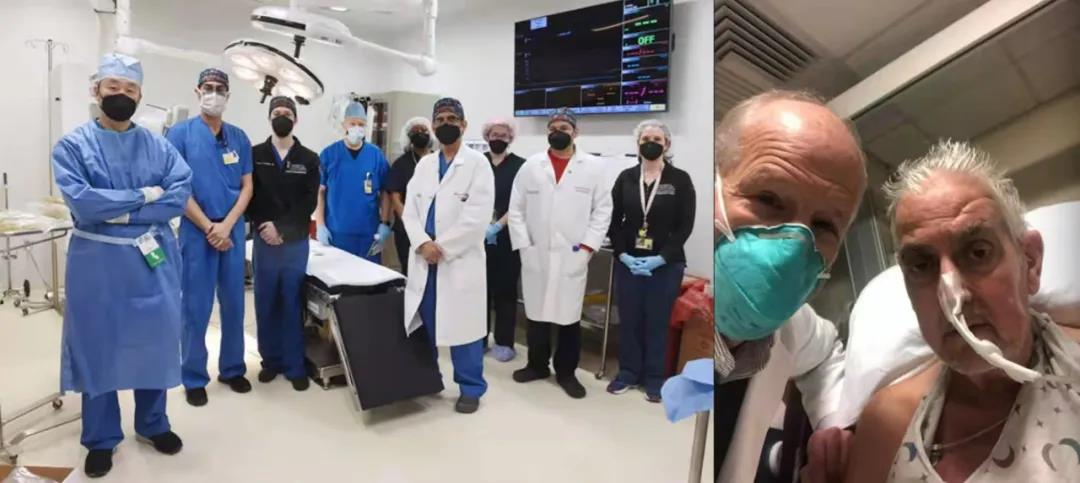
Mohiuddin博士移植团队与病人(图源:马里兰大学医学院)
供应心脏的猪由United Therapeutics Corporation的子公司Revivicor提供。为了满足手术需求,这头一岁大,240磅的供体猪已进行过基因改造。科学家们对这头猪的基因进行了10处修改,其中敲除了3个基因以降低人体免疫系统的攻击性排异反应,敲除了1个生长激素受体的基因以防止移植后猪心继续生长,插入了6个人类基因以提高猪心对人类免疫系统的耐受性,分别为:两个抗炎基因,两个促进正常凝血和防止血管损伤的基因,以及另外两个有助于抑制抗体反应的调节蛋白。除此之外,该公司还提供了标准免疫抑制剂,以及一种实验性抗排斥药物(Kiniksa Pharmaceuticals;Lexington,Massachusetts),预防器官移植手术后的排异反应。
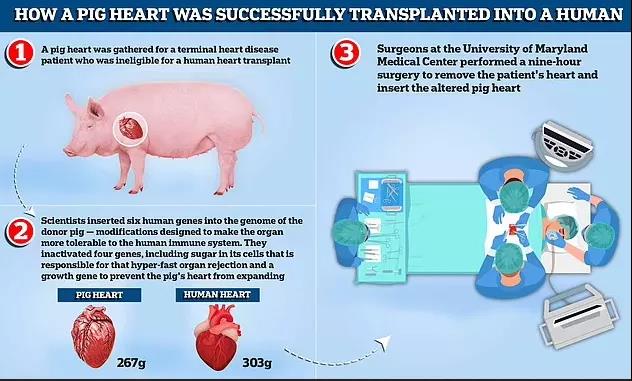
心脏供体制作过程(图源:马里兰大学医学院)
作为该项手术的主导者,马里兰大学医学院外科教授Muhammad M. Mohiuddin说:“这是我们多年复杂研究的成果,在此之前,已经在存活时间超过九个月的动物身上不断练习技术。通过对我们的实验数据分析,FDA最终授权我们对一名没有其他治疗方案可选择的终末期心脏病患者进行移植手术。这项手术的成功为器官移植提供了具有价值的信息,以帮助医学界在未来不断改进这种可能挽救患者生命的移植方案。”同为团队成员的马里兰大学医学中心心脏移植项目主任Bartley P. Griffith说:“对医学界来说,这是一项具有突破性的手术,它的成功让我们看到了异种移植的可能,让解决器官短缺危机更进一步,因为国际范围内根本没有足够的心脏供体来满足心脏病人的需求。我们谨慎尝试,也较为乐观的认为这项世界首创的手术在未来将为患者提供新的选择。”
01 动物世界千千万,为何偏爱猪供体?
随着科技的不断发展,现代医学已经可以通过移植人类器官以延长或治疗器官功能衰竭个体的生命,但目前的器官供体数量远远不能满足需求,每天都有很多人在等待器官移植的过程中死去。截止2022年1月11日,中国人体器官捐献管理中心登记的志愿捐献人数为4352680,完成捐献37939例,捐献器官113618个。目前,我国每年约有150万因末期器官功能衰竭需要移植的患者,但仅有1万多人有机会获得器官移植,供需比例为1:150。因此寻求新的器官供体以满足人类需求,是近几百年来一直亟待攻克的难题。
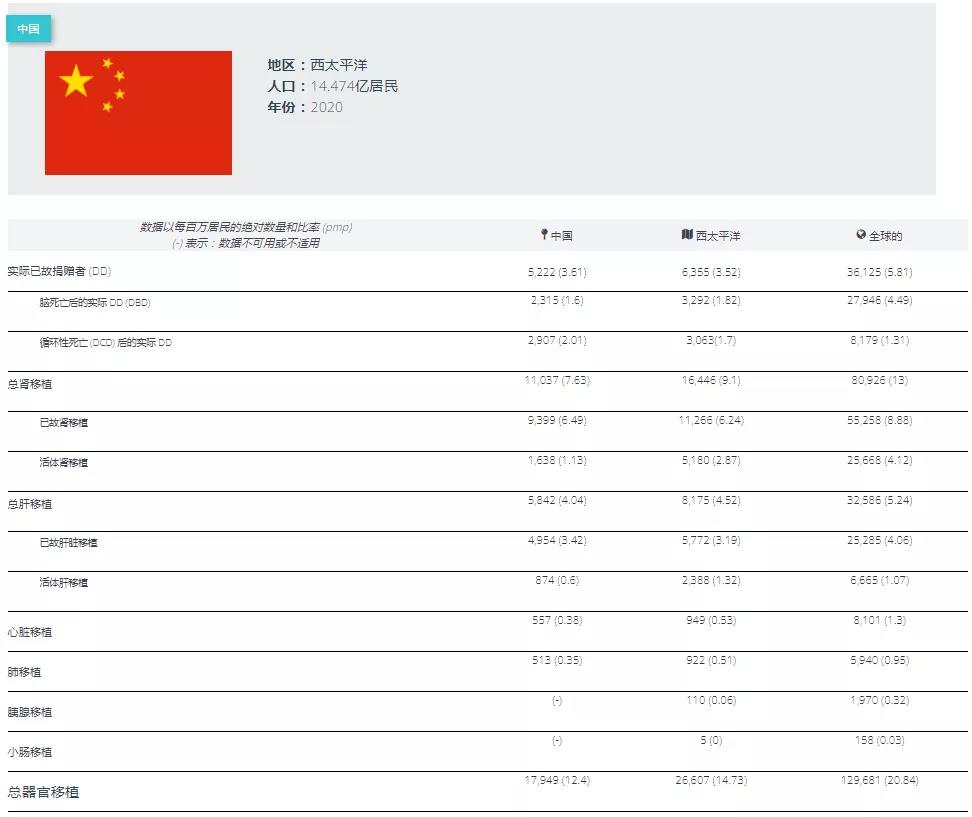
中国2020年器官捐献和移植情况(图源:Global Observatory on Donation and Transplantation)
从异体器官选择来说,灵长类动物因与人类的高度相似成为了器官供体的首选,但正因高度相似,导致灵长类疾病在人类中传播。与此同时,灵长类动物漫长的繁殖周期,无法满足人类对器官的迫切需求,而且多数灵长类动物在国际上属于保护动物,再加上较高的饲养成本,不利于临床推广。
经过对狒狒、山羊、兔子、狗等一系列的尝试失败后,科学家将目光投向了猪。人类在漫长的吃猪岁月中,逐渐发现猪的内脏器官在形态结构上与人类器官非常相似,从解剖学和生理学来说,也能够满足人类器官移植的要求。此外,猪的快速繁殖能力和食物利用率,也为其作为器官移植供体提供了时效性和高性价比。然而,免疫排斥反应和猪内源性反转录病(Porcine endogenous retroviruses,PERVs)成为了“人猪融合”的障碍。受困于此,接下来的几十年研究止步不前,而在医院等待器官移植的人却越来越多。“魔剪”CRISPR/Cas9的出现,让问题的解决出现了曙光,研究者使用CRISPR/Cas9技术使得猪身上的器官不再携带病毒,并且降低器官可能产生的免疫反应。
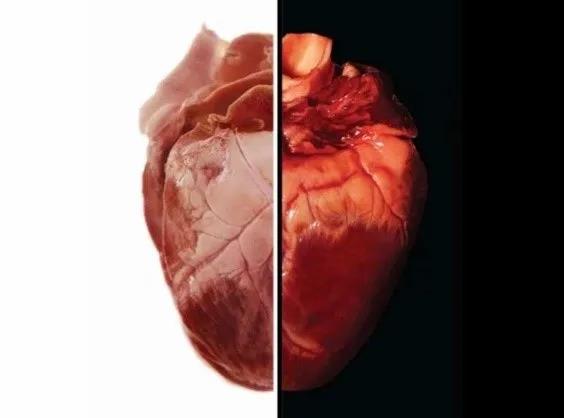
猪的心脏与人的心脏对比(图源:BBC,左侧猪心,右侧人心)

研究结果(图源:Science)
以猪的器官作为移植供体,一直都有研究。在2018年12月,德国慕尼黑Walter Brendel实验医学中心的Bruno Reichart团队在Nature发表的研究结果表明将基因修饰后的猪心脏移植到狒狒体内获得了成功,且狒狒最长存活时间为6个月。随后,2020年10月美国麻省总医院在Circulation发表的研究结果表明猪心有望成为人类心脏移植供体,并预测人类或最早于2021年底接受猪心移植。2021年10月,纽约大学朗格尼医学中心(NYU Langone Health)的外科医生Robert Montgomery采取了一项惊人的举措:在征得患者家属同意的情况下,他们将经过基因改良的猪的肾连接到一名靠呼吸机维持生命的脑死亡患者身上,然后该器官开始正常运作,“几乎立刻”就开始制造尿液和肌酐废物,这是第一次进行的异体移植手术。

研究成果(图源:Nature)

研究成果(图源:Circulation)
02 基因改造猪器官,短期可大量生产?
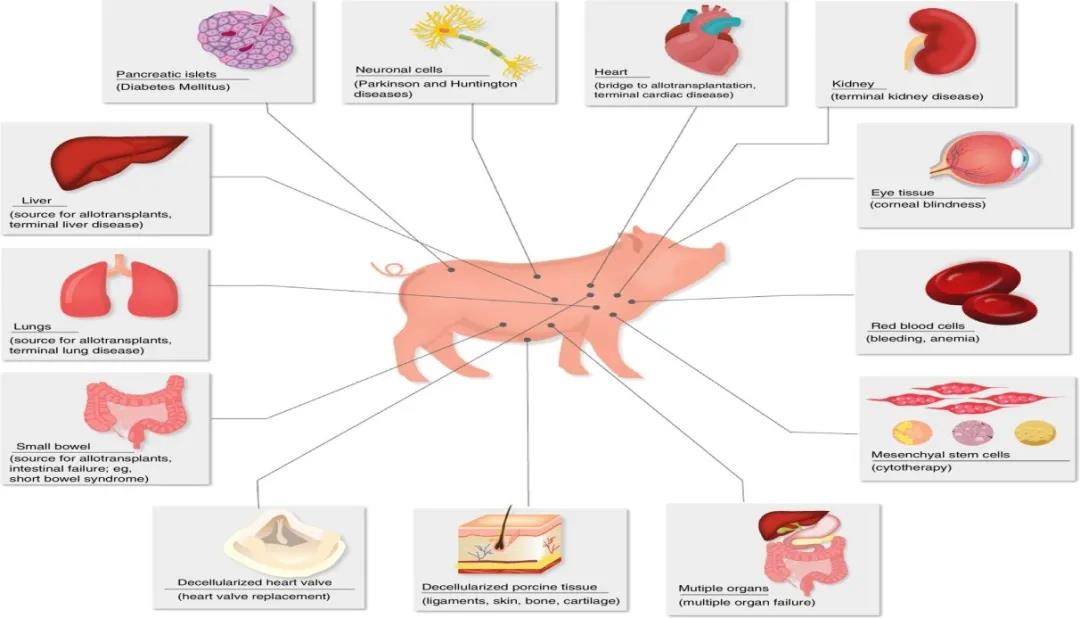
几个世纪以来,猪一直是医学分析的对象。早在1150年,Cofon the Younger就编写了Porci Anatomy,这是一本医学生用来研究解剖学的手册。因为猪和人的内在有相似之处。猪和人通过冠状动脉的血液分布几乎相同,皮肤结构相似,头几个月的胚胎发育非常相似,和人类之间的遗传学也有很多共同点。2012年首次对猪的基因组测序,目前已将猪的器官应用到胰岛、皮肤、角膜等诸多异体移植。

以猪为供体的异体移植器官(图源:Nature)
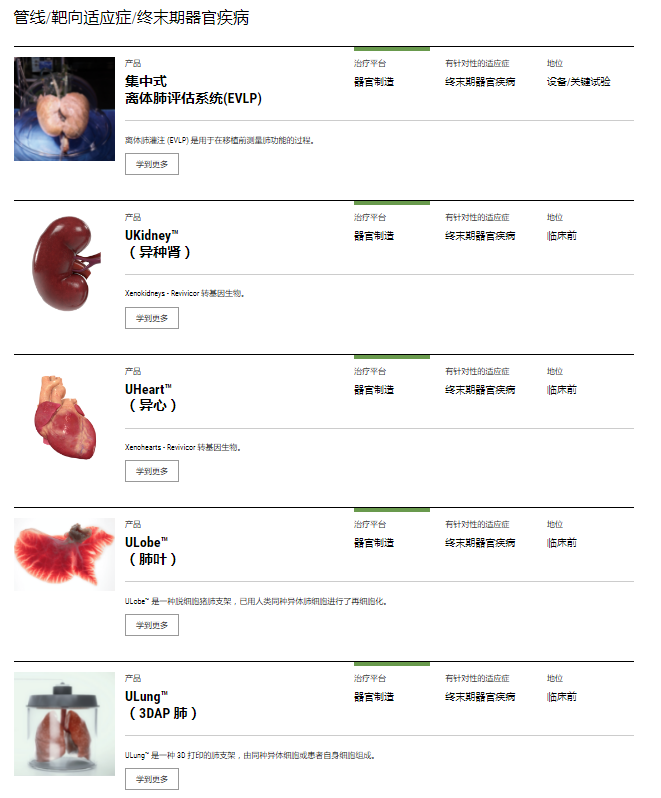
猪器官在进行异体移植之前都需要进行基因改造,以使其能够满足移植需求。为全球第一例猪肾异体移植和猪心异体移植提供供体的United Therapeutics Corporation是美国的一家生物技术公司,并在纳斯达克上市,代码为UTHR。公司宗旨是为肺部疾病和有器官移植需求的患者开发创新型、延长生命的技术。目前,其子公司Revivicor正在开发“人造器官”类医疗产品,一直在试验猪的克隆和基因改造,以制造人体不会排斥的异体器官,以期解决人类器官移植难题。这种类型的生物制剂将作为衰竭器官的替代品移植到患者体内。该公司拥有通过异种移植、同种异体再细胞化和自体生物打印技术开发的再生医学产品。该公司正在建设新的临床级设施,用于饲养满足 FDA 对此类试验要求的猪,预计该试验将在2023年底推出。
United Therapeutics Corporation“人造器官”产品列表(图源:United Therapeutics Corporation官网)
03 异种移植前沿赛道,少数企业临床布局
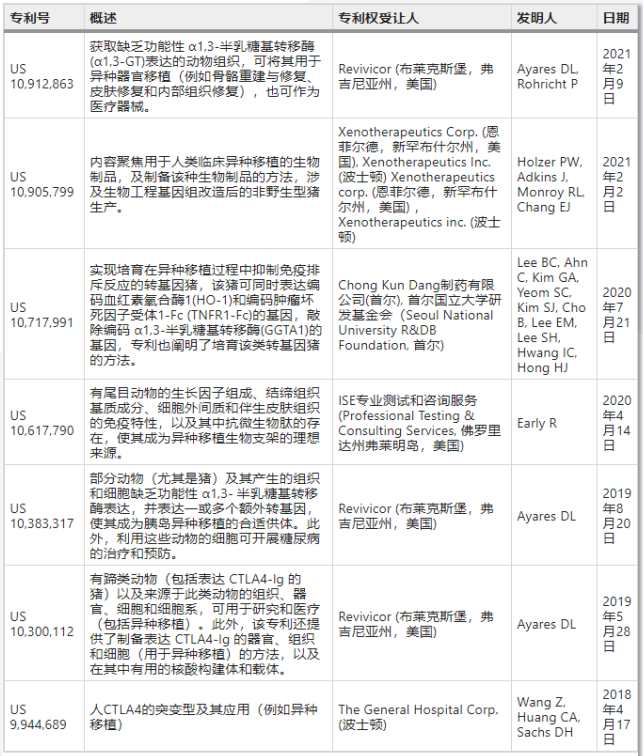
表1. 异种移植专利布局
数据来源:[6]
国内外异种移植公司(图源:各公司官网)
作为前沿科技,异种移植赛道成员屈指可数,仅有美国、德国、中国和日本少数国家,而且大部分以实验室研究为主。相关领域的专利布局已于2021年发布于Nature Biotechnology,整理如表1所示。在企业方面,头部领跑主要为美国企业,如:eGenesis、Recombinetics、United Therapeutic、Xeno Therapeutics,中国企业蓄势待发,主要有:启函生物、臻质医疗、中科奥格等。
撰文|文竞择
排版|木子久
参考资料:
[1]https://www.science.org/content/article/here-s-how-scientists-pulled-first-pig-human-heart-transplant
[2]Niu D, Wei HJ, Lin L, et al. Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science. 2017 Sep 22;357(6357):1303-1307. doi: 10.1126/science.aan4187. Epub 2017 Aug 10. PMID: 28798043; PMCID: PMC5813284.
[3]Umani Ronchi F, Napoletano G. Uterus Transplantation and the redefinition of core bioethics precepts. Acta Biomed. 2021 Nov 3;92(5):e2021435.doi: 10.23750/abm.v92i5.12257. PMID: 34738555; PMCID: PMC8689330.
[4]Längin M, Mayr T, Reichart B,et al. Consistent success in life-supporting porcine cardiac xenotransplantation. Nature. 2018 Dec;564(7736):430-433. doi: 10.1038/s41586-018-0765-z. Epub 2018 Dec 5. Erratum in: Nature. 2019 Apr;568(7752):E7. PMID: 30518863.
[5]Pierson RN 3rd, Fishman JA, Lewis GD, et al. Progress Toward Cardiac Xenotransplantation. Circulation. 2020 Oct 6;142(14):1389-1398. doi: 10.1161/CIRCULATIONAHA.120.048186. Epub 2020 Oct 5. PMID: 33017208; PMCID: PMC7990044.







