在肿瘤浸润淋巴细胞(TIL)治疗后,免疫系统的T细胞可以靶向肿瘤并清除实体癌。
2023年7月24日,英国卡迪夫大学Andrew K. Sewell团队在Cell 在线发表题为“Targeting of multiple tumor-associated antigens by individual T cell receptors during successful cancer immunotherapy”的研究论文,该研究使用组合肽库和蛋白质组学数据库来揭示IV期恶性黑色素瘤成功TIL治疗后持续性癌症特异性T细胞受体(TCRs)的抗原特异性。
值得注意的是,单个TCRs可以通过HLA A*02:01-限制性表位分别来自Melan A、BST2和IMP2的EAAGIGILTV、LLLGIGILVL和NLSALGIFST靶向多种不同的肿瘤类型。与三种抗原结合的TCR的原子结构揭示了共享的x-x-x-A/G-I/L-G-I-x-x-x识别基序的重要性。多表位靶向允许单个T细胞同时以几种方式攻击癌症。与传统T细胞对单个表位的识别相比,这种“多管齐下”的T细胞表现出对癌细胞的卓越识别,使它们成为未来免疫疗法开发的有吸引力的候选者。

人白细胞抗原I类(HLA-I)递呈途径在细胞表面以短肽的形式显示细胞蛋白质组。这些肽-HLA分子被细胞毒性T淋巴细胞(CTLs)表面的T细胞受体(TCRs)询问该系统允许CTLs检测和破坏细胞内病原体或细胞转化引起的蛋白质表达异常的细胞。利用检查点阻断和肿瘤浸润淋巴细胞(TIL)治疗,使用CTLs区分健康细胞和癌细胞蛋白质组的能力,在癌症治疗方面取得了50多年来最大的进展。胸腺中的T细胞选择过程决定了与那些识别病原体来源(非自身)肽的T细胞相比,具有TCRs的T细胞与肿瘤相关抗原(TAAs)肽结合能力相对较弱由于TCR亲和力控制着T细胞的功能谱,因此已知天然癌症特异性T细胞对癌细胞表面天然水平的肽的反应不是最优的。然而,检查点阻断和TIL疗法诱导实体瘤完全缓解表明,天然TCR与肽-HLA相互作用可以根除癌症。
在“成功”的癌症免疫治疗中,T细胞靶向的抗原和表位在很大程度上仍然未知。作者研究了自体肿瘤特异性T细胞在TIL输注产品中用于诱导HLA A*02:01+ IV期恶性黑色素瘤患者MM909.24的完全持久缓解。该研究开发了一个名为CANTiGEN平台,用于发现未知特异性的癌症反应性T细胞(所谓的“孤儿”T细胞)识别的配体。这个名为CANTiGEN的平台成功预测了八种不同的癌症特异性TCR识别的抗原,并鉴定出,除了源自Melan A的EAAGIGILTV肽外,用于成功治疗患者MM909.24的TIL中占主导地位的黑色素A反应性T细胞克隆MEL8,还识别了两种新的癌症相关表位:来自tetherin的LLLGIGILVL,也称为CD317和骨髓基质抗原2(BST2)。
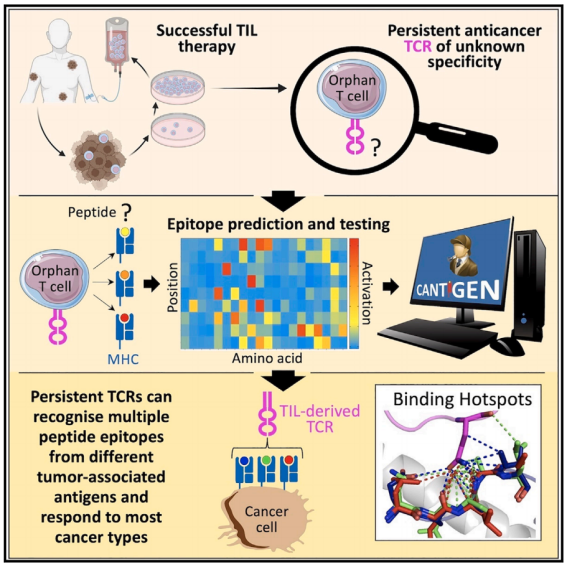
机理模式图(图源自Cell )
用含有所有三个表位的HLA A*02:01四聚体染色的MEL8 T细胞克隆。用三种抗原的四聚体对用于治疗患者MM909.24的TIL产品进行染色,表明患者分别输注了超过9.7×109、4.7×109和9.6×109个Melan A-、BST2-和IMP2反应性T细胞。TIL输注产品中的其他几种T细胞克隆型可以对所有三种抗原都有反应,而之前用于TCR-T过继性细胞疗法的DMF4 TCR只对Melan A有反应。该研究采用了“多管齐下”这个术语来描述可以同时通过多个TAA靶向癌症的T细胞。
重要的是,与单个TAA识别癌细胞的传统T细胞相比,通过每个TAA识别癌细胞是叠加性的,导致多管齐下的T细胞对癌细胞的识别优于通过单个TAA识别癌细胞。作者发现单个成功的TCRs可以通过几种不同的HLA呈递表位识别许多癌症,这使得这种TCRs在免疫治疗中良好的开发潜力。总而言之,这项研究表明,接受了TIL治疗的癌症幸存者体内的单个T细胞可以同时识别多个不同的癌症抗原靶标,并杀死多种癌症。
文章来源“iNature”