肿瘤微环境在原发性和继发性肝癌中各具特色。B细胞是免疫浸润的重要组成部分。
2023年6月26日,中山大学彭穗团队在Cancer Research上在线发表题为“Crosstalk between myeloid and B cells shapes the distinct microenvironments of primary and secondary liver cancer”的研究论文。该研究证明了B细胞是肝细胞癌(HCC)和结直肠癌肝转移(CRLM)微环境中的重要调节因子。B细胞在HCC和CRLM中表现出不同的发育轨迹。单细胞分析发现,IgG+浆细胞在HCC中优先富集,而IgA+浆细胞在CRLM中优先富集。机制上,HCC中IgG+浆细胞通过CXCR3-CXCL10轴被肿瘤相关巨噬细胞募集,而CRLM中IgA+浆细胞通过CCR10-CCL28信号被转移的肿瘤细胞募集。
在功能上,IgG+浆细胞在HCC中优先促进促瘤巨噬细胞的形成,IgA+浆细胞在CRLM中优先诱导粒系髓源抑制性细胞的活化。临床上,HCC中IgG+浆细胞和巨噬细胞的浸润增加与更差的生存相关,而CRLM中肿瘤内IgA+浆细胞和中性粒细胞的增加预示着较差的预后。综上所述,该研究证明了HCC和CRLM中血浆和髓系细胞介导的免疫抑制,表明选择性地调节原发性或继发性肿瘤相关的免疫抑制调节网络可能会重新编程微环境,为治疗肝癌提供一种免疫治疗策略。

肿瘤微环境(TME)是指肿瘤细胞与其他细胞,特别是免疫细胞相互作用的微环境,在塑造癌症的各个方面,从早期启动到转移性疾病中起着至关重要的作用。由于TME的大量工作,越来越多的免疫治疗,特别是免疫检查点阻断(ICB),极大地改变了抗癌治疗的格局。然而,由于肝脏是高度免疫耐受的器官,肿瘤免疫治疗在肝癌中受到阻碍。
肝癌根据器官来源可分为原发性肝癌和继发性肝癌。肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝癌的75%-80%,是全球癌症相关死亡率的第四大原因。HCC几乎完全发生在慢性炎症的环境中,而慢性炎症显著影响肝脏微环境。相比之下,约50%的继发性肝癌起源于结直肠癌,肝转移的发生显著抑制了免疫治疗的效果,降低了5年生存率。值得注意的是,转移的肿瘤细胞可以募集炎症和免疫细胞,重塑肝脏微环境。因此,HCC和结直肠癌肝转移(CRLM)微环境的调控机制极其不同,导致不同的免疫治疗策略。更好地理解表征HCC和CRLM微环境的复杂免疫网络将为TME的调控机制和肝癌的免疫治疗策略提供新的见解。
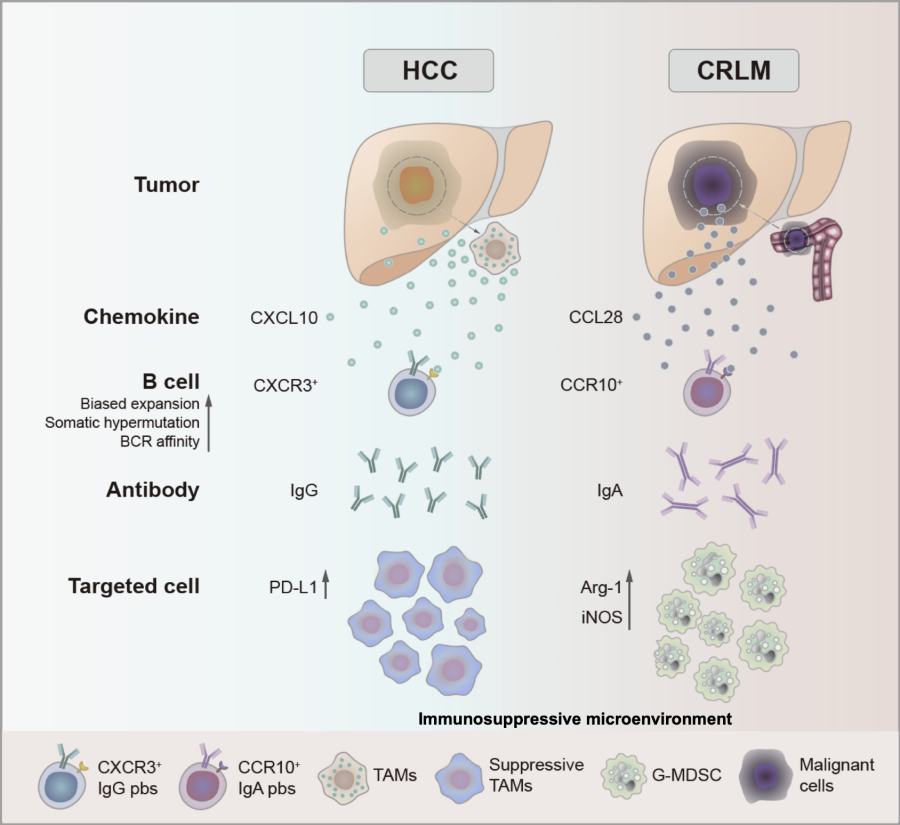
HCC中的IgG+浆细胞通过CXCR3-CXCL10轴被TAMs招募,而CRLM中的IgA+浆细胞通过CCR10-CCL28轴被肿瘤细胞招募,介导不同的免疫抑制作用
B细胞是肿瘤免疫浸润的重要组成部分,在免疫调节、抗原呈递和抗体分泌等方面发挥重要作用。B细胞的组织分布与趋化因子受体的表达密切相关。在分化为浆细胞的过程中,CXCR3的表达允许免疫球蛋白G(IgG)浆细胞迁移到炎症组织,而CCR9和CCR10的表达允许IgA浆细胞归巢到黏膜组织。考虑到B细胞的转运机制,我们推断HCC和CRLM微环境具有不同的肿瘤浸润B细胞模式。然而,迄今为止,无论是在HC还是CRLM中,B细胞的亚群组成、生物学功能和调控机制均未见报道。
髓系细胞包括单核细胞来源和粒细胞来源的亚群,具有不同的Fc受体表达模式,可与免疫球蛋白的Fc部分结合,诱导强大的免疫反应。然而,关于Fc受体在肿瘤浸润的髓系细胞中的表达谱知之甚少。在本研究中,我们通过对从HCC肿瘤和癌旁组织以及9例CRLM组织中分离的20000多个单个B细胞进行单细胞分析,揭示了B细胞在HCC和CRLM中的亚群组成和生物学功能。首先,该研究发现IgG型浆细胞在HCC肿瘤中优先富集,而IgA型浆细胞在CRLM中优先富集。
机制上,在HCC中,肿瘤相关巨噬细胞通过CXCR3-CXCL10轴募集IgG浆细胞。这些IgG浆细胞主要促进致瘤性巨噬细胞的形成。与HCC相比,IgA浆细胞在CRLM中被肿瘤细胞通过CCR10-CCL28轴募集。这些IgA浆细胞主要影响粒系髓系来源的抑制性细胞(G-MDSC),抑制抗肿瘤免疫。临床上,HCC中的IgG浆细胞和CRLM中的IgA浆细胞均与更差的预后相关。综上所述,该研究证明了HCC和CRLM中血浆和髓系细胞介导的免疫抑制,表明选择性地调节原发性或继发性肿瘤相关的免疫抑制调节网络可能会重新编程微环境,为治疗肝癌提供一种免疫治疗策略。
文章来源“iNature”