嵌合抗原受体(CAR) T细胞疗法可以有效地治疗人类癌症,但CAR识别的抗原缺失是一个主要障碍。
2023年7月5日,宾夕法尼亚大学马乐园及麻省理工学院Darrell J. Irvine共同通讯在Cell 在线发表题为“Vaccine-boosted CAR T crosstalk with host immunity to reject tumors with antigen heterogeneity”的研究论文,该研究发现CAR-T细胞的体内疫苗增强触发内源性免疫系统的参与,以避免抗原阴性肿瘤逃逸。
疫苗增强的CAR-T促进树突状细胞(DC)向肿瘤募集,增加DC对肿瘤抗原的摄取,并引发内源性抗肿瘤T细胞的启动。这一过程伴随着CAR-T代谢向氧化磷酸化(OXPHOS)的转变,并且严重依赖于CAR-T衍生的IFN-γ。由疫苗增强的CAR-T诱导的抗原扩散(AS)即使在初始肿瘤为50% CAR抗原阴性时也能实现一定比例的完全缓解,并且通过CAR-T IFN-γ表达的基因扩增进一步增强了异质肿瘤控制。因此,CAR-T细胞衍生的IFN-γ在促进AS中起着关键作用,而疫苗增强提供了一种临床可转化的策略来驱动针对实体肿瘤的这种反应。

使用嵌合抗原受体(CAR) T细胞的过继细胞疗法(ACT)已经彻底改变了复发/难治性CD19+ B细胞急性淋巴细胞白血病和淋巴瘤的治疗。在实体瘤的情况下,CAR-T疗法迄今为止还不太成功,尽管在解决肿瘤浸润有限、CAR-T功能差和持久性等问题方面取得了进展。然而,CAR-T细胞治疗肿瘤的两个关键挑战是预先存在的抗原异质性,即并非所有肿瘤细胞都表达CAR靶向的抗原,以及治疗过程中发生的抗原丢失。即使在最初对CD19 CAR-T治疗有反应的白血病患者中,也经常观察到CD19抗原的缺失或下调,并经常导致疾病复发。
在ACT的背景下抗原扩散(AS)是对不同于原始治疗靶点的次级抗原的免疫反应的诱导和扩增,利用CAR-T细胞靶向一种表面表达抗原,同时诱导内源性T细胞对其他肿瘤抗原的反应,将是克服肿瘤异质性和抗原损失介导逃逸的一种有吸引力的方法。越来越多的证据表明,在癌症免疫治疗期间,AS可以引起并可能有助于整体治疗结果。此外,在临床前和临床CAR-T细胞治疗的少数病例中记录了抗肿瘤抗体反应增加或T细胞反应弱。
尽管如此,迄今为止,CAR-T细胞疗法本身诱导具有治疗意义的AS的证据有限。临床前,大多数CAR-T研究使用免疫缺陷小鼠,根据定义排除内源性T细胞反应。在免疫能力强的小鼠模型中,CAR-T疗法本身触发AS的能力似乎有限,尤其是在实体瘤中。相比之下,CAR-T细胞工程与额外的免疫反应刺激分子,包括FLT3L, CD40L, IL-12, IL-18和IL-7/CCL19或当与溶瘤病毒联合使用时,已报道显示出抗肿瘤活性增加。然而,将这些额外的效应功能引入到具有统一活性的CAR-T细胞中可能具有挑战性,并导致新的安全风险。更重要的是,不管CAR-T细胞的形态如何,在ACT过程中AS被促进的机制仍然知之甚少。
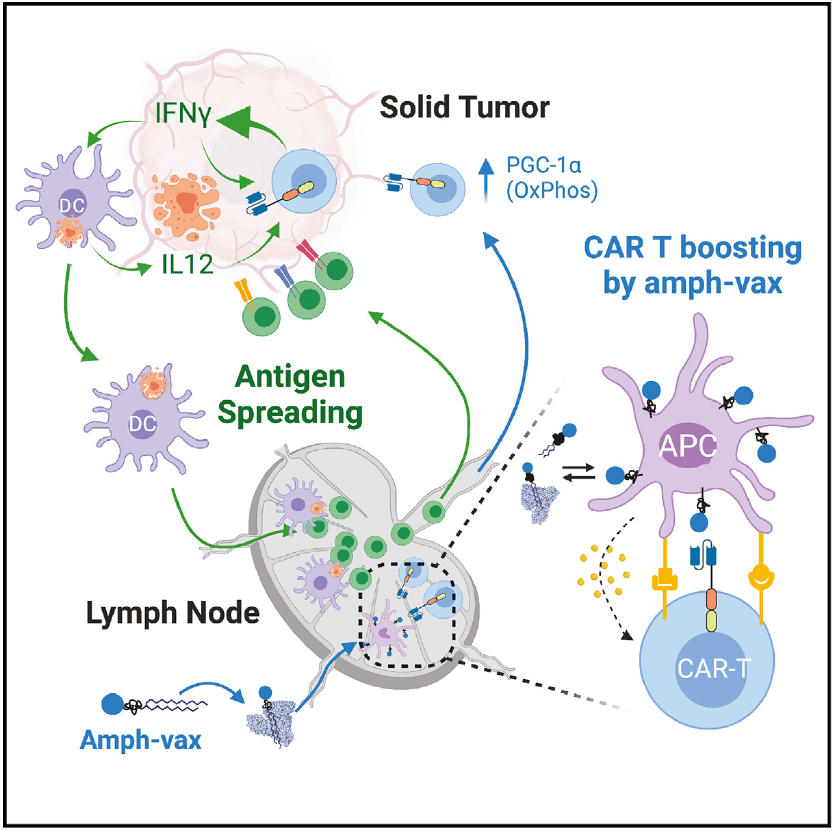
文章模式图(图源自Cell )
最近描述了一种增强实体肿瘤中CAR-T活性的方法,即通过淋巴结中的CAR-T细胞的疫苗样增强CAR-T细胞,这是通过合成与两亲性聚合物脂质尾部结合的CAR配体来完成的,在肠外注射后,CAR-T配体有效地运输到引流淋巴结(dLNs),并用CAR-T配体修饰巨噬细胞和树突状细胞(DCs)的表面。CAR-T细胞在淋巴结中遇到配体修饰的树突状细胞,通过CAR与天然共刺激受体信号和来自配体呈递细胞的细胞因子刺激一起接受刺激,导致CAR-T细胞扩增和功能增强。通过给药这些“amph-配体”和疫苗佐剂来增强CAR-T细胞的疫苗,大大增强了CAR-T细胞治疗的肿瘤排斥反应。
该研究使用CAR-T疗法与疫苗增强相结合的方法作为模型设置,以了解AS在清除抗原性异质实体瘤中的作用,并确定AS的潜在机制。在多个小鼠同基因肿瘤模型中,该研究发现使用第二代CAR-T细胞治疗引起的AS可以忽略不计。然而,即使在淋巴细胞耗竭(LD)预处理的情况下,疫苗增强CAR-T细胞也能显著诱导内源性T细胞启动。这一过程严重依赖于IFN-γ,通过疫苗增强或基因工程诱导的IFN-γ表达增强使CAR-T细胞能够控制具有预先存在的抗原异质性的实体肿瘤。