基因工程猪心脏异种移植于2022年1月7日在一名57岁终末期心力衰竭的男性患者身上进行,该患者不适合同种异体移植,需要静脉-动脉体外膜氧合支持。
2023年6月29日,马里兰大学Muhammad M Mohiuddin团队在The Lancet在线发表题为“Graft dysfunction in compassionate use of geneticallyengineered pig-to-human cardiac xenotransplantation: a case report ”的研究论文,该研究报告了1例基因工程猪对人异种心脏移植的移植功能障碍,在这项报告中详细介绍了目前对影响异种移植结果的重要因素。

异种移植成功后,超声心动图显示移植物功能良好,心血管和其他器官系统功能持续,直到术后第47天发生舒张性心力衰竭。术后第50天,心内膜活检显示毛细血管受损,伴有间质水肿、红细胞外渗、罕见的血栓性微血管病变和补体沉积。低丙种球蛋白血症在注射免疫球蛋白(IVIG)后和第一次血浆交换期间检测到抗猪异种抗体增加,主要是IgG。术后第56天的心内膜活检显示与进行性心肌僵硬一致的纤维化改变。微生物无细胞DNA检测显示PCMV/PRV无细胞DNA滴度增加。死后单细胞RNA测序显示原因重叠。
该研究确定了观察到的内皮损伤的潜在介质。首先,广泛的内皮损伤表明抗体介导的排斥反应。第二,IVIG与供体内皮强烈结合,可能导致免疫激活。最后,异种移植物中潜伏的猪巨细胞病毒或猪玫瑰病毒(PCMV/PRV)的再激活和复制可能引发破坏性的炎症反应。研究结果指出了未来改善异种移植结果的具体措施。
第一次利用基因工程将猪心脏移植到人类身上引发了近三十年来研究的高潮。之前的研究表明,狒狒在基因工程移植猪心脏后,异位和正位异种移植物的存活时间最长。导致人类受体死亡的临床过程已在前面描述过。最值得注意的是,受体有舒张衰竭的快速发作和整体病理性心肌增厚的异种移植物。
该研究是人类首次成功移植来自10基因修饰猪的异种心脏,尽管受体存在先前的疾病和多种手术或非手术并发症,但仍能维持生命,直到患者在术后60天因移植失败死亡。患者在接受移植后血流动力学稳定,移植物功能良好,持续47天,无任何肌力变化,无药物或应激引起的异常变时性或离子性反应,超声心动图稳定。然而,异种移植物很快变得水肿并失去舒张功能。心内膜活组织检查显示间质内有积液和红细胞,且很少有炎症细胞。在接下来的几天里,间质性水肿被纤维化组织所取代。此时,患者病情迅速恶化,经家属同意撤回支持,患者死亡。
第二次活检是在术后第50天进行的,主要是由于异种移植物突然舒张衰竭引起的。心内膜活检显示间质水肿、呈梭形细胞(成纤维细胞)、内皮组织紊乱和红细胞外渗。可见C4d、IgG和IgM沉积。电镜显示约50%的毛细血管有严重的内皮损伤,内皮细胞坏死或明显的细胞质肿胀和膜断裂。周围有间质性水肿和局灶性红细胞外渗。邻近的肌细胞表现为退行性改变,包括细胞质肿胀、肌丝紊乱和局灶性肌细胞坏死。术后第56天的心肌内膜活检组织病理学显示40%的细胞缺血性心肌细胞坏死并伴有纤维间质扩张。微血管中含有罕见的微血栓。电镜下,80-85%的毛细血管明显异常。毛细血管内皮核明显增大,胞浆肿胀。一些毛细血管基底膜脱落,壁轮廓异常,或毛细血管的连续性丧失。
在患者者中检测各种病原体的微生物cfDNA的结果显示,PCMV/PRV的cfDNA呈进行性增加。对异种移植前猪器官的回顾性分析发现,肾、肝、脾和肺中PCMV/PRV DNA的拷贝数可以忽略。在第45天分离的受体PBMC DNA检测支持最初报道的PCMV/PRV DNA血症的存在。在患者去世后,用PCR对受体和异种移植物的不同部位进行PCMV/PRV的全面评估。所有受体器官均检测到PCMV/PRV DNA和猪细胞DNA。
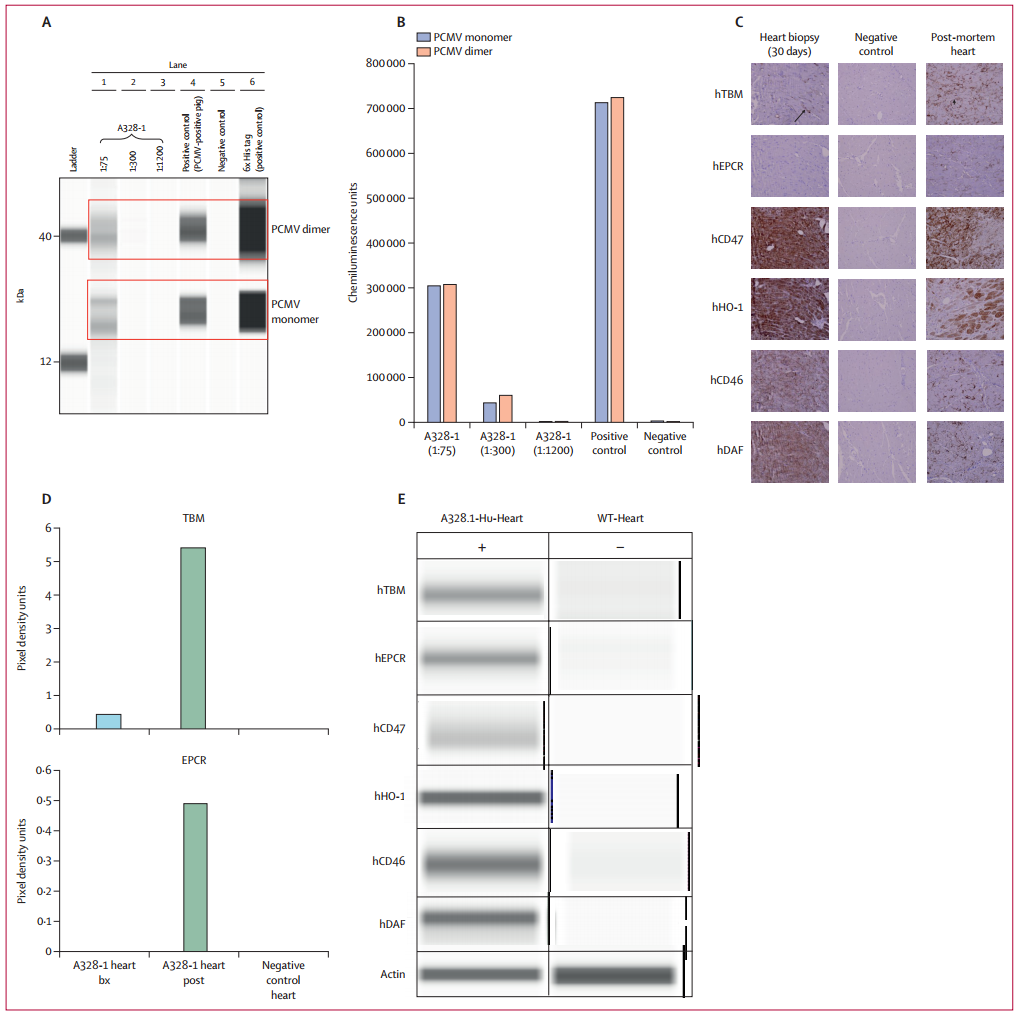
异种移植后供体PCMV和转基因表达状况(图源:The Lancet)
由于全血细胞减少症和对复发性感染的易感性,患者的免疫抑制必须从NHP模型的成功水平降低。霉酚酸酯是非NHP实验中免疫抑制的重要成分。霉酚酸酯在术后20-54天完全停用,可能导致了异种抗体介导的内皮细胞损伤。加入他克莫司代替霉酚酸酯,在NHP研究中,对预防排斥反应无效。NHP研究表明,需要高剂量的2C10R4才能有效抑制B细胞功能只要存在有效的抗CD40共刺激阻断,就不会出现抗移植物抗体。在复杂的移植情况下,KPL-404在人体内的最低有效剂量尚未确定。因此,该患者的目标是提供可达到的最高浓度,根据安全性研究的适当情况,考虑到外部因素。增加的炎症反应可能增加了维持该患者治疗水平所需的药物量(例如,靶标介导的药物处置)。此外,肾脏替代疗法、渗出性积液、IVIG与内皮细胞结合阻止Fc与抗体结合以及血浆置换等外在因素也可能降低这种治疗性抗体对其靶点的生物利用度。
根据其他NHP异种移植的病理结果和该患者的活检,异种抗体介导的排斥反应的可能性也需要考虑。第一次活检显示内皮损伤,一次活检显示低C4d沉积,最后一次活检显示有限的血栓。这些发现是与抗体介导的排斥反应相关的特征,可能是由于受体免疫抑制药物水平降低所致。一些转基因基因(hHO1、hCD47、hCD46和hDAF)的表达下降,可能是由于内皮细胞的丢失。然而,其保护功能的丧失是不可否认的。死后hEPCR和hTBM表达增加,可能是对炎症的反应。
总体而言,这个实验移植是成功的,患者存活了60天,异种移植物在最初的47天内功能良好。在NHP实验中成功使用的免疫抑制不能持续应用于该患者,因为他的合并症,包括全血细胞减少症。遗憾的是,发现PCMV/PRV存在于异种移植物中,并且必须给予IVIG以治疗严重的低γ球蛋白血症。研究发现,移植物特性(如潜伏病毒的激活)和受体特性(如免疫低下状态)可能在移植物功能障碍中起作用。这一经验为今后的异种移植提供了宝贵的经验教训:(1)必须避免在异种移植物中出现潜在潜伏病毒的任何机会;(2)使用IVIG和减少免疫抑制可能需要强有力的理由,并应尽一切努力使用NHP实验中显示的免疫抑制;(3)正确确定共刺激阻断抗体的剂量和监测至关重要;(4)单独使用他克莫司在任何异种移植试验中均未显示出疗效,必须谨慎使用;(5)更严格的患者选择是可取的。
总之,除了一些意想不到的并发症外,基因工程猪心脏和基于抗CD40的方案可以维持患者60天的生命。更多的基因工程实现从猪到人的移植可以提高我对人类异种移植失败机制的理解,并帮助人们更好地管理临床异种移植。
文章来源“iNature”