本文转载自“丁香学术”微信公众号。
限制时间饮食(Time-restricted feeding, TRF),是近年来受关注较多的一种饮食模式。在多种模式生物以及人类中的研究中均发现,饮食限制是一种高度保守性的延缓衰老并促进长寿的干预策略。
长期以来,对饮食限制调节衰老和长寿的绝大部分研究以食物中提供能量的营养物质为对象,探究它们是如何参与该过程及相应的分子机制。例如,有研究发现,对于肥胖人群而言,16 小时的 TRF 可以安全有效地降低体重、内脏脂肪、低密度脂蛋白胆固醇、糖化血红蛋白水平。
随着日升日落,我们的机体活动随着光线的变化,存在着「睡眠-觉醒」的昼夜节律性变化。与此同时,我们也存在饮食的节律,即「进食-禁食」的周期,由于 TRF 控制喂食的时间,而不是营养或热量,因此 TRF 有可能依赖于昼夜调节功能,不过其作用的潜在分子机制尚不清楚。
2021 年 9 月 29 日,哥伦比亚大学瓦格洛斯内科和外科学院发育与遗传系的研究团队在国际顶尖期刊 Nature 发表了题为 Circadian autophagy drives iTRF-mediated longevity 的文章,该研究借助果蝇这一模式生物,揭示了间歇性 TRF(iTRF)饮食方案能够有力地延长果蝇的寿命,并推迟了肌肉和肠道中衰老标记物的出现;同时,他们还发现,iTRF 介导的寿命延长既需要昼夜调节,也需要自噬的参与。
由于在人类衰老过程中,昼夜节律调节和自噬都是高度保守的过程,因此,这项工作强调了行为或药物干预刺激昼夜节律调节自噬的可能性,可能会为人们提供类似的健康益处,如延缓衰老和延长寿命。

图片来源:Nature
主要研究内容
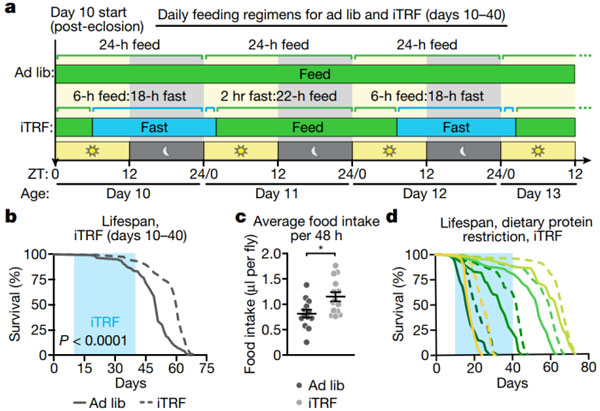
首先,研究人员测试了四种 iTRF 饮食方案,通过试验和结果评估,他们确定了一个中间时间段的喂养策略,发现这种策略可以稳健地延长寿命。
为了排除能量限制导致的寿命延长,他们在 iTRF 恢复期进行补偿性摄食,使其平均食物消耗量相对于对照组略有增加,结果仍然没有改变寿命延长的事实。
因此,iTRF 并不通过限制营养摄入来延长寿命。同样地,他们的实验结果还表明 iTRF 介导的寿命延长可以独立于日常蛋白质限制介导的长寿。
图片来源:Nature
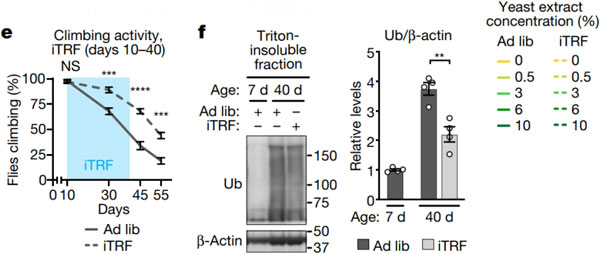
为了评估 iTRF 的抗衰老作用,他们检测了已知的与年龄相关的肌肉/神经元功能、蛋白质聚集和肠道功能的变化。
首先,为了评估整体肌肉/神经元功能,他们测试了果蝇的攀爬能力。与自由饮食的果蝇相比,iTRF 的果蝇表现出较低的年龄相关性攀爬能力下降;为了测量与年龄相关的蛋白质聚集的保守标记,他们对从 iTRF 前和 iTRF 后的果蝇和随意饮食的果蝇提取物中进行泛素蛋白的检测,结果发现,与对照组果蝇相比,iTRF 果蝇的不溶部分水平降低,表明与衰老相关的蛋白质聚集较少。
总之,这些结果表明,与随意饮食对照组相比,iTRF 降低了多个衰老参数,并表明 iTRF 通过增加健康寿命和延缓衰老来延长寿命。
图片来源:Nature
iTRF 需要完整的生物钟
由于 iTRF 不改变饮食成分,但控制喂食时间,所以研究人员接下来探究了昼夜节律在其中的作用。前期有研究表明,TRF 方案可增强昼夜基因的表达。为了证实 iTRF 的效果,他们每 4 小时对自由采食和 iTRF 喂养的动物进行定量实时荧光定量分析。结果发现,iTRF 的确可以上调节律相关基因 Clk,per 和 tim 的表达幅度,特别是在夜间/禁食期。因此,与其他 TRF 方案相似,iTRF 可增强昼夜基因表达。
为了检验昼夜节律是否对 iTRF 介导的寿命延长是必需的,他们比较了几种昼夜节律相关基因突变体及其在随意饮食和 iTRF 饮食中的遗传对照。结果表明,对照组在 iTRF 上表现出显著的寿命延长,而昼夜节律基因突变组则没有。所以说,iTRF 介导的寿命延长需要一个有功能且完善的生物钟。
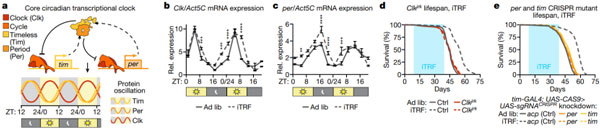
图片来源:Nature
iTRF 需要自噬的参与
由于 TRF 涉及到禁食,而饥饿会诱导细胞自噬这一生物学过程,所以研究人员探索了自噬在其中的作用。他们首先使用 qRT-PCR 检测了两种保守的自噬基因 Atg1 和 Atg8a 在果蝇体内是否受生物钟调控。与其他模型生物和细胞培养结果一致,Atg1 和 Atg8a 在果蝇中均受昼夜节律调节,且在夜间达到高峰。
与昼夜节律基因类似,在对照组中 iTRF 增强了自噬基因 Atg1 和 Atg8a 的夜间表达,但在 per01 突变体中没有该变化。因此,这两个关键的自噬基因的表达是由 iTRF 调控和增强的,并依赖于生物钟。
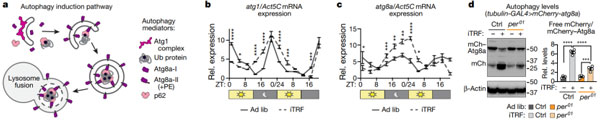
图片来源:Nature
为了直接检测 Atg1 和 Atg8a 的作用,他们利用 RNA 干扰(RNAi)介导的基因敲降技术来降低 Atg1 和 Atg8a 的表达。结果发现,在野生型组中,抑制 Atg1 和 Atg8a 可阻止 iTRF 介导的寿命延长,而在 per01 突变体中则无影响。
所以说,这些数据表明,自噬的激活对 iTRF 介导的寿命延长是必要的。
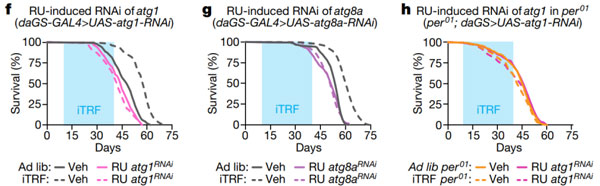
图片来源:Nature
iTRF 需要昼夜节律的自噬
最后,为了检测自噬的昼夜节律调控是否影响 iTRF 介导的健康益处,研究团队开发了昼夜节律启动子和 UAS-GAL4 系统。他们使用 per-GAL4 和 tim-GAL4 分别驱动针对 Atg1 和 Atg8a 的 RNAi 构建体系在夜间高表达和白天低表达。结果表明,夜间 Atg1 和 Atg8a 敲低的果蝇对 iTRF 没有反应,表明夜间 Atg1 和 Atg8a 表达是 iTRF 介导的寿命延长所必需的。
而夜晚特异性过表达 Atg1 和 Atg8a 的果蝇不仅在随意饮食中表现出类似 iTRF 的寿命延长,而且在 iTRF 上也没有表现出额外的寿命延长。这表明,如果昼夜节律调节的自噬已经增强,那么 iTRF 没有作用。
所以说,增强昼夜调节的自噬才是 iTRF 介导的寿命延长的主要机制。后续药物的干预实验同样证明了这一点。因此,上述这些数据表明,夜晚特异性的 Atg1 表达增强对于 iTRF 介导的寿命延长是必要和充分的。
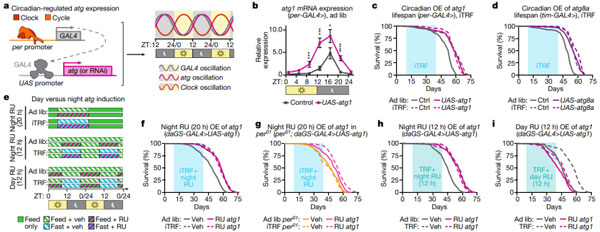
图片来源:Nature
结语
衰老是死亡的一个主要风险因素,它引发了导致代谢、心血管和神经退行性疾病的病理过程。作为一种简单的饮食干预策略,iTRF 似乎既有效又多效,对多种组织有益,并提供了一种潜在的对抗衰老的新方法。
这项研究确定了生物钟基因(Tim, Per,Cyc 和 Clk)和必要的自噬基因 Atg1 和 Atg8a 对于 iTRF 的抗衰老和延长寿命的益处是必要且充分的,iTRF 介导的寿命延长需要一个有功能的昼夜节律钟。随着细胞自噬靶点的多样性,识别 iTRF 介导的主要组织和特定靶点并将其与自噬相关的健康益处相关联是未来工作的重点。
「我们发现限时饮食发挥延长寿命的好处,需要正常的昼夜节律,也需要自噬反应。」本研究的通讯作者 Mimi Shirasu-Hiza 教授说,「缺少任何一个要素,饮食就不会让动物长寿。」
这也就是说,禁食的时机非常关键,只有在夜晚禁食的果蝇寿命得到延长;而在白天禁食,晚上吃东西的果蝇寿命并没有发生改变。
看到这里,吃宵夜的朋友们是不是要敲敲警钟了?
为了方便您继续收到我们的文章,欢迎您将我们设为“星标”,这样您以后就可以看到我们的消息啦。
参考资料:
1.Matt Ulgherait et al. Circadian autophagy drives iTRF-mediated longevity. Nature (2021).
2.Villanueva, J. E. et al. Time-restricted feeding restores muscle function in Drosophila models of obesity and circadian-rhythm disruption. Nat. Commun. 10, 2700 (2019).
3.de Cabo, R. & Mattson, M. P. Effects of intermittent fasting on health, aging, and disease. N. Engl. J. Med. 381, 2541–2551 (2019).