COVID-19爆发初期,美国再生医学联盟(ARM)还不确定大流行及其伴随的经济衰退会如何影响细胞和基因治疗领域。随着2020年上半年画上句号,这一问题的答案趋于明朗。近日,ARM在一份名为“Advancing Innovation During COVID-19”的报告中表示,在2020年上半年,再生医学(基因疗法、细胞疗法、组织工程等)领域融资金额达107亿美元,超过2019年融资的总资金,比2019年上半年增长了120%。
ARM首席执行官Janet Lambert表示,“这些令人惊讶的融资数字证明了现在对该行业的所有热情。我认为这种热情的驱动因素仍然存在,并对2020年下半年感到乐观。”

具体来说,这107亿美元中,几个IPO超级抢眼。包括,中国CAR-T选手传奇生物(Legend Biotech)在6月份以4.87亿美元在华尔街首次亮相领跑全球。同月,基因治疗公司Generation Bio和Akouos分别筹集了2.3亿美元和2.44亿美元。今年2月,另一家基因治疗公司Passage Bio 筹集了2.84亿美元,而基因编辑生物技术Beam Therapeutics 筹集了2.07亿美元。
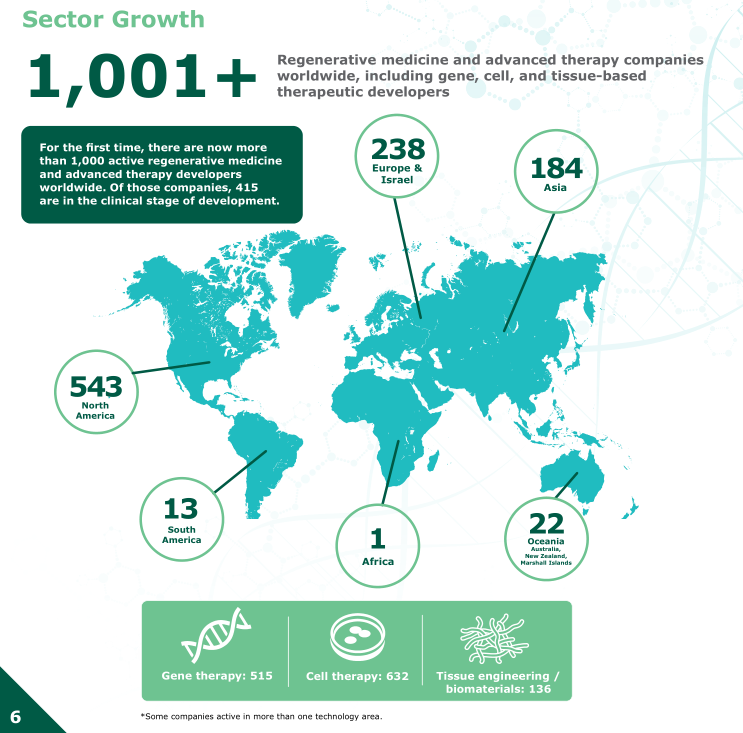
据报告统计,2020年上半年,世界范围内首次有超过1000家再生医学和先进疗法的开发者。其中,致力于开发基因治疗515家,细胞治疗632家,组织工程/生物材料136家。在这些公司中,有415家处于临床研发阶段。

尽管面临COVID-19带来的经济挑战,但2020年有望成为再生医学融资破纪录的一年。医疗开发商在2020年上半年筹集的资金超过了2019年全年(H1 2020年为107亿美元,而2019年为98亿美元)。2018年是细胞和基因治疗融资记录最好的一年(融资总额为135亿美元),相比之下,治疗开发商已经筹集了2018年全年融资总额的近80%。到2020年,几乎所有融资领域的增速都将超过前几年,私募/管道融资和并购融资除外。


2020上半年,全球有1078项临床试验正在进行中,其中1期临床试验394项,2期临床试验587项,3期临床试验97项。此外,基于细胞的癌症免疫疗法的临床试验共有471项。值得注意的是,全球有11项正在进行的临床试验利用再生医学和先进疗法治疗COVID-19。


尽管COVID-19带来了挑战,再生医学和先进疗法领域的开发人员继续推进各种适应症的临床项目,以满足医疗需求。这里罗列了2020年上半年的关键发展里程碑:
开发人员继续将临床后期候选产品推向市场(包括中国和日本):
·6月9日,Mallinckrodt公司宣布,已向美国FDA完成生物制剂许可证申请(BLA)的提交,以将其通用型人类皮肤替代制品Stratatech用于深Ⅱ度烧伤的成年患者。
·5月19日,诺华公司旗下的AveXis公司宣布,FDA已批准将Zolgensma用于治疗2岁以下运动神经元存活基因1(SMN1)出现双等位基因突变的SMA儿童患者。3月19日,Zolgensma在日本获批。
·4月1日,Mesoblast宣布,FDA已接受其同种异体细胞疗法Ryoncil(remestemcel-L)的生物制品许可申请(BLA),用于治疗类固醇难治性急性移植物抗宿主病(SR-aGVHD)儿童患者。FDA同时授予该申请优先审评资格,预计将于今年9月30日前做出回复。
·在日本和中国已针对Kite / Gilead的Yescarta提交了治疗B细胞淋巴瘤的销售许可:
3月30日,第一三共在日本提交了Yescarta的申请
2月24日,复星凯特在中国提交了Yescarta的申请
·2月13日,百时美施贵宝(Bristol-Myers Squibb)因其CAR-T疗法liso-cel治疗复发或难治性大B细胞淋巴瘤成年患者而获得FDA的优先审查
·2月10日,Kite 宣布其CAR-T疗法KTE-X19进入FDA优先审查通道,该疗法用于治疗复发或难治的套细胞淋巴瘤。1月28日,欧洲药品管理局(EMA)通过了KTE-X19的市场营销授权申请。
·1月13日,PTC Therapeutics向欧洲药品管理局(EMA)提交了基因疗法PT-AADC的申请,用于治疗芳香族L-氨基酸脱羧酶缺乏症(AADC)。
基因疗法在治疗数年后继续显示出长期的持久性:
·6月17日,制药公司BioMarin宣布了正在进行的I / II期试验结果,长达四年的数据显示,输注实验性基因疗法valoctocogene roxaparvovec后,严重A型血友病患者的出血率显著降低,累积年平均出血率(ABR)下降了95%,VIII因子水平得到改善。
·3月24日,诺华公司旗下的AveXis宣布,一项Zolgensma治疗脊髓性肌萎缩症长期随访研究的数据显示,一次剂量的Zolgensma在治疗5年后的患者体内仍然有效。该研究中所有接受治疗的患者均存活,且不依赖于永久通气。

FDA和EMA继续为再生医学和先进疗法的快速批准开“绿色通道”:
·5月11日,CRISPR治疗公司和Vertex制药公司宣布,美国FDA授予CTX001 再生医学高级疗法(RMAT)资格。CTX001 是一种研究性、自体基因编辑的造血干细胞疗法,将用于治疗严重的严重镰刀型细胞贫血病(SCD)和输血依赖性β地中海贫血(TDT)。
·5月6日,Immunicum宣布,Ilixadencel(一种用于治疗肾癌的细胞疗法)获得FDA的RMAT资格。
·4月22日,诺华因其用于治疗滤泡性淋巴瘤的CAR-T疗法Kymriah获得RMAT资格。
·4月16日,TissueTech 的TTAX02获得FDA RMAT资格,TTAX02是他们基于组织的候选产品用于脊柱裂的宫内胎儿外科手术修复。
·3月2日,MeriaGTx和Janssen的AAV-RPGR基因疗法用于X连锁性色素性视网膜炎的治疗获得EMA的优先药物计划(PRIME)资格。
·2月27日,Tessa Therapeutics的CAR-T治疗复发性或难治性CD30阳性经典霍奇金淋巴瘤的CAR-T治疗获得FDA的RMAT资格。
·2月12日,AlloVir的Viralym-M获得了EMA的PRIME称号,Viralym-M是一种用于治疗或治疗免疫受损患者的BK病毒、巨细胞病毒、人疱疹病毒6型、爱泼斯坦巴尔病毒和/或腺病毒严重感染的细胞疗法。
基因编辑技术不断发展,开发人员已开始提供显示临床疗效的数据:
·6月12日, CRISPR Therapeutics和Vertex Pharmaceuticals公司在2020年欧洲血液学协会(EHA)年会上公布了基于CRISPR基因编辑的自体造血干细胞疗法CTX001的临床试验数据。数据显示:CTX001输注9个月,该患者没有发生VOC,没有输血,总血红蛋白水平为11.8 g/dL,胎儿血红蛋白46.1%,F-细胞99.7%。
·Allogene Therapeutics和亘喜生物(Gracell Bio)报告了各自基因编辑的同种异体CAR-T疗法的临床试验的初步数据:
·5月29日,Allogene Therapeutics公布ALLO-501(同种异体)用于复发性或难治性非霍奇金淋巴瘤结果:在一项正在进行的对19名可评估患者进行的1期研究中,37%的患者经历了完全缓解,另外26%的患者经历了部分缓解。
·4月28日,亘喜生物(Gracell Bio)公布了其通用型TruUCAR GC027治疗复发性或难治性(R/R)急性T淋巴细胞白血病(T-ALL)的一项I期临床试验的结果:在1期研究中,5名(100%)受试者获得完全缓解,其中包括血细胞数量完全或未完全恢复(CR/CRi);4名(80%)受试者获得最小残留疾病阴性的完全缓解(MRD-CR)。
·3月4日,Editas和Allergan联合宣布,CRISPR 疗法 AGN-151587(EDIT-101)治疗莱伯氏先天性黑蒙症 10 型(Leber congenital amaurosis 10,LCA 10)的 I/II 期临床试验已完成首例患者给药。
·1月8日,Locus Bio启动了CRISPR增强噬菌体的首次临床试验。

总结来说,2020年是与众不同的一年。我们看到了很多药物的临床试验因为疫情原因而中断,许多再生医学公司都面临着患者招募、登记、数据收集和随访方面的挑战。但是随着疫情控制趋于稳定,开发者和监管机构都认识到,中断临床可能会对患者带来的灾难性后果,监管机构也已表现出在保持健康和安全高标准的同时保持灵活性的意愿。一切都在变的好起来。
参考资料
Innovation in the Time of COVID-19