国际顶级期经过四个多月的评选,终于在近期的《Cell》“Best of 2017”特刊中刊登其评选结果,包括“2017年度十大最佳论文”以及“2017年度四大最佳综述”。不出意料的,这些文章涵盖癌症、免疫学、干细胞、神经科学等热门研究领域,以及很火的AI技术在生物医学领域的研究进展。

但是有一篇综述的入选确实有点出乎意外,就是这篇题为“Putting p53 in Context”的文章。为什么仅仅对一个蛋白质的综述就可以独占鳌头呢?p53又是什么呢?有什么强大的功能呢?为什么会受到科研工作者的青昧呢?在下文中我们将进行详细的解答。
p53蛋白在肿瘤抑制中具有重要作用
p53是一种大小为53kD的蛋白质。首先在肿瘤的病毒研究中被发现,结合猿猴病毒40(SV40)在病毒转化细胞中的T抗原。发现之初归类为致癌基因,随着研究的深入,发现这一分类是错误的。研究发现TP53基因编码的野生型p53抑制细胞生长和致癌转化,并且在人类肿瘤中失活TP53突变是常见的。在许多癌症中,TP53突变与不良患者预后相关。p53通过诱导细胞周期阻滞或凋亡程序能够抑制癌症,可以响应多种不同的细胞应激信号。现在,科研人员公认p53是一种重要的肿瘤抑制因子。
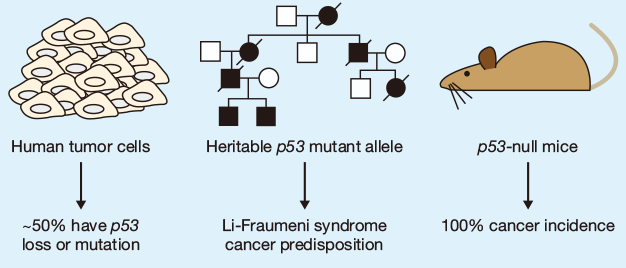
从上图的研究结果,我们可以看出,p53蛋白在人类癌症中具有肿瘤抑制作用。近50%的癌症类型发生p53突变。突变型p53等位基因的遗传可以使人类患上Li-Fraumeni癌症综合征。p53失活的小鼠百分百会发生癌症。
p53蛋白作为肿瘤抑制基因,限制不适当细胞的扩增过程,失活会促进肿瘤发生或发展。p53蛋白通过细胞应激传感器限制肿瘤发展,可以响应DNA损伤、缺氧、癌基因表达、营养剥夺及核糖体功能障碍等多种细胞信号,限制细胞在这些不利条件下的增殖。p53响应DNA损伤,对致癌信号作出反应,促进细胞凋亡或衰老。在低水平的压力条件下,p53可以引发保护性的促生存应答,比如暂时的细胞周期停滞、DNA修复或产生抗氧化蛋白,进而维持基因组的完整性和修复损伤细胞的活力。
怎样才能被认为是“肿瘤抑制”呢?
唯一的指标就是这个基因是否会损害体内肿瘤的发生或发展。科研人员构建了p53基因敲除小鼠这一模型。
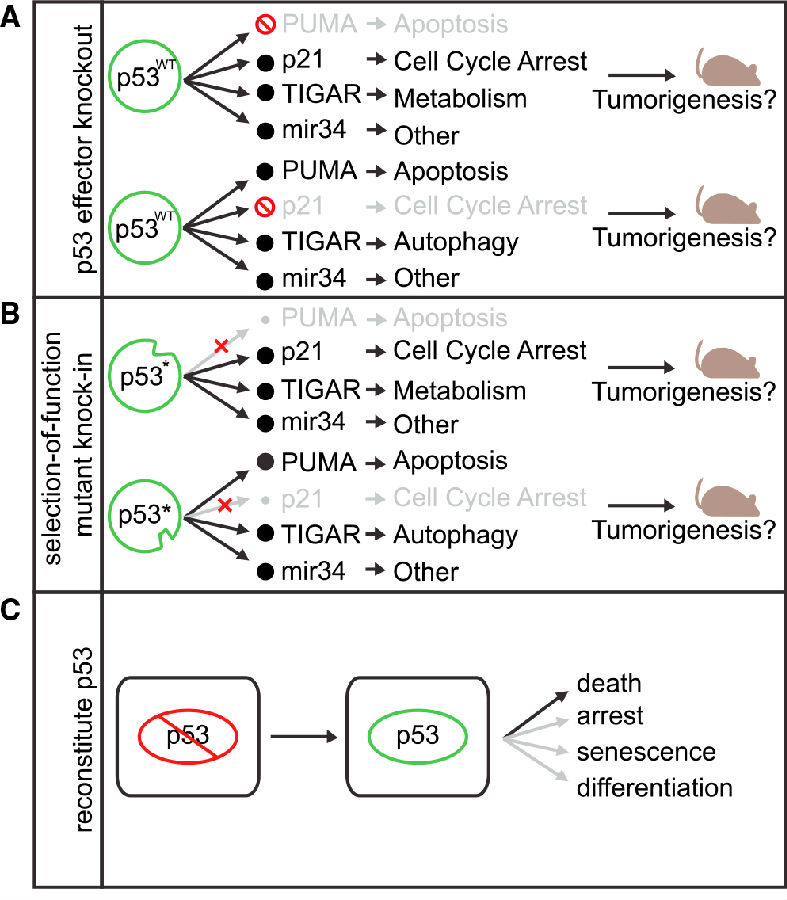 科研人员对携带p53靶基因敲除的小鼠与p53本身的肿瘤发病和病理(上图A)进行研究,发现缺乏p21、PUMA和Noxa的小鼠,胸腺淋巴瘤不发展。这一结果暗示p53介导的细胞周期停滞和细胞凋亡对于肿瘤抑制可能是不必要的。但是这种研究高估了特定p53蛋白对无效表现的贡献,比如p53靶基因可能已经在基础水平表达,p53无效细胞决不是p21无效的。相反由于多种信号介导p53的输出,低估了靶向过程中对肿瘤抑制的影响。
科研人员对携带p53靶基因敲除的小鼠与p53本身的肿瘤发病和病理(上图A)进行研究,发现缺乏p21、PUMA和Noxa的小鼠,胸腺淋巴瘤不发展。这一结果暗示p53介导的细胞周期停滞和细胞凋亡对于肿瘤抑制可能是不必要的。但是这种研究高估了特定p53蛋白对无效表现的贡献,比如p53靶基因可能已经在基础水平表达,p53无效细胞决不是p21无效的。相反由于多种信号介导p53的输出,低估了靶向过程中对肿瘤抑制的影响。
进一步的研究通过选择性保留或失去调节p53靶基因和活性的某些突变体分离p53效应(上图B)。例如,肿瘤来源的p53R175P和p53E180R等位基因在凋亡中显示缺陷,同时保留引起细胞周期停滞的能力,从而与无p53的动物相比,携带相同突变的小鼠显示出较长无肿瘤存活时间。此外,在这些小鼠中发生的肿瘤显示比p53无效的肿瘤少得多,表明不同的p53突变体可能选择性地影响下游效应器途径。虽然这些研究强化了p53介导的转录抑制肿瘤的重要性,但它们并没有确定一个关键过程。突变型p53蛋白可能比野生型蛋白更稳定或更不稳定,因此差异表型可反映定量和定性影响。
还有一些研究绕过了围绕p53外围个体功能的调控问题,不在p53损失时测量肿瘤发作,而是利用携带“可切换”p53等位基因的小鼠品系在已建立的肿瘤中重新唤醒内源性p53(上图C)。在所有检查的情况下,p53恢复产生显著提高抗肿瘤反应。在表达Myc的B细胞淋巴瘤中会造成大量凋亡;在肝癌和肉瘤中能引起细胞衰老。在其他情况下,p53再激活可以引发细胞分化和失去自我更新。
p53具有典型的转录激活蛋白结构域
p53蛋白是调控转录的序列特异性DNA结合蛋白。p53蛋白由两个N-末端反式激活结构域组成,其后是保守的富含脯氨酸结构域,中央DNA结合结构域和编码其核定位信号的C末端以及转录活性所需的寡聚化结构域。与其他转录因子类似,p53具有模块化的蛋白质结构域结构。p53的N端包含两个转录激活结构域(TAD),TAD1和TAD2,分别跨越氨基酸残基1-40和40-60。这些结构域可通过募集组蛋白修饰酶、基础转录机制的组分和共激活剂复合物(如STAGA和Mediator)独立增强p53靶基因的转录。C-末端到反式激活结构域之间,残基60-95之间,是富含脯氨酸结构域(PRD),在该结构域的蛋白质-蛋白质相互作用位点中携带脯氨酸-丙氨酸点突变的敲入小鼠看起来是正常的,而完整的结构域缺失会破坏p53肿瘤抑制剂功能。跨越残基100-300的p53的核心核心包含负责蛋白质的序列特异性结合至DNA中的p53应答元件的DNA结合结构域。大部分与癌相关的p53突变是该结构域中的错义突变,并使DNA结合丧失能力,说明DNA结合对于p53介导的肿瘤抑制的关键重要性。最后,p53在残基363-393之间的C末端含有一个碱性的富含赖氨酸的结构域。
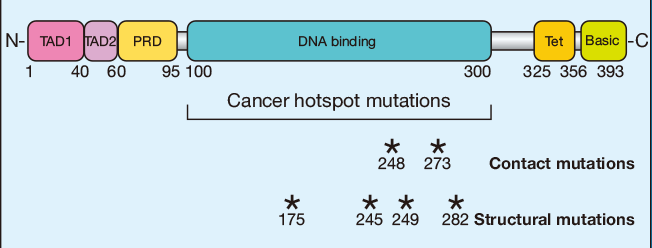
与肿瘤抑制中p53介导的转录的重要性一致,绝大多数肿瘤来源的TP53突变发生在编码p53的DNA结合结构域的区域中。在正常细胞中,p53蛋白由一系列调节因子维持在低水平,如MDM2,起到p53泛素连接酶的作用以促进其降解。然而,p53响应于各种细胞压力而稳定,包括由于失调的癌基因产生的DNA损伤和复制压力。导致p53激活的机制可以是刺激依赖性的:例如,DNA损伤促进p53磷酸化,阻断MDM2介导的降解,而致癌信号传导诱导ARF肿瘤抑制剂抑制MDM2。在癌症中改变的六种最常见的p53氨基酸残基(称为“热点”)是R175,G245,R248,R249,R273和R282。除了破坏DNA结合之外,这些突变还可以赋予p53的功能获得性,并且与肿瘤侵袭和转移的增加有关。
p53被称为“基因组卫士”
在DNA损伤后,p53被激活以促进受损细胞的消除或修复,最终降低其传播突变的风险。DNA损伤应答(DDR)激酶磷酸化p53,驱动细胞周期停滞、衰老或细胞凋亡。此外,p53通过激活编码DNA修复靶基因来刺激DNA修复,在体外某些DNA修复活性中p53缺失的细胞是有缺陷的。
p53与癌基因协同转化细胞的直接性表明基因组不稳定性不是肿瘤启动所必需的。尽管如此,由p53损失引起的基因组不稳定性使得能够获得额外的驱动并加速转化、转移和耐药性的潜力,提高了p53失活有助于肿瘤内异质性的可能性。
p53控制广泛和灵活的网络
随着研究的深入,p53的功能不仅只有调节基因组完整性、细胞周期停滞和细胞凋亡这些功能,还有一些“非常规”的功能,比如调节自噬、改变新陈代谢、抑制多能性和细胞可塑性以及促进铁依赖形式的细胞死亡等,甚至基础水平的p53可以强化多种其他肿瘤抑制网络。p53的反应非常灵活,取决于细胞类型、分化状态、压力条件和环境信号等。
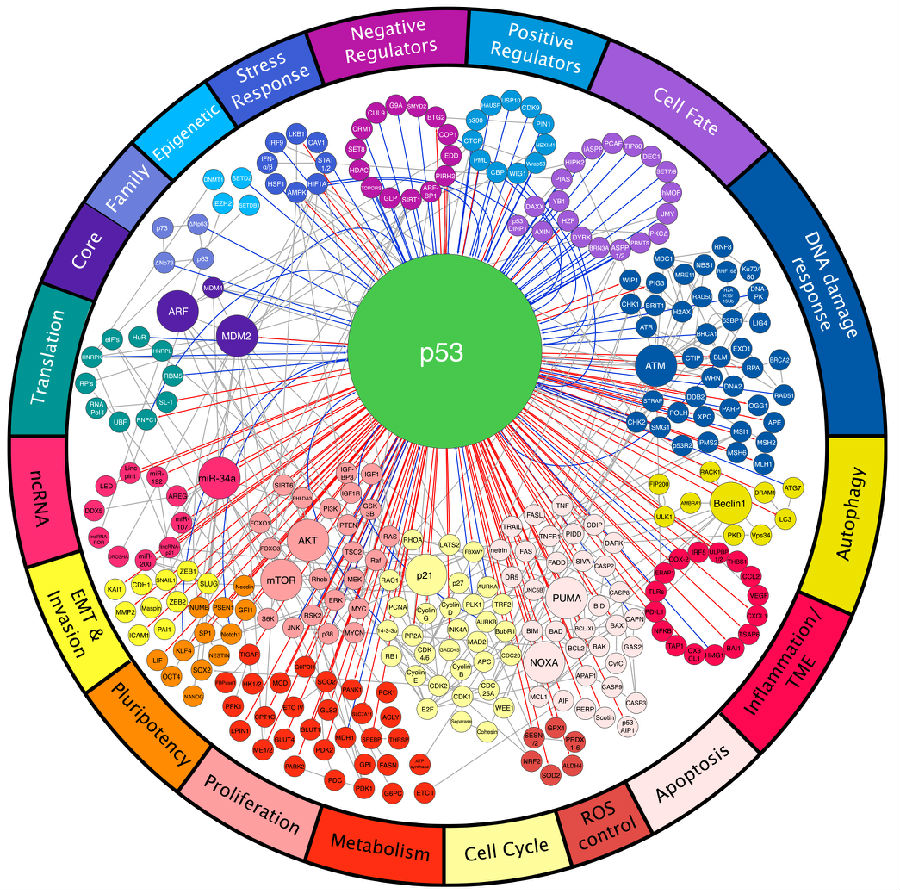
p53的不同功能构成了一个庞大复杂的信号网络。在图中,每一个节点就代表一个基因,每一条线就是一个交互反应。p53的激活需要多种信号通路(蓝线),同样的p53也会影响多种信号通路(红线)。例如,细胞周期停滞和凋亡分别与p21或促凋亡Bcl-2蛋白的上调相关。还可以证明p53会控制组织重塑、自噬、ROS控制以及代谢等过程。
科研人员一直想要找到一套通用的p53靶基因,但目前还没有实现。比如对16个全基因组数据进行Meta分析,约有60个基因被认为是靶点基因。虽然数据表明p53可以控制多种生物反应过程,但其中一个或多个过程占主导地位的生理环境尚未完全理解并进行更系统的研究。细胞代谢是受到较多关注的p53控制过程。但是改变细胞类型,p53也可能对相同的代谢过程具有相反的作用。例如,在乳腺癌和肺癌细胞中,p53通过减弱葡萄糖摄取或抑制糖酵解酶的表达来抑制糖酵解。相反,在肌细胞中,p53诱导糖酵解酶表达从而促进糖酵解。
p53诱导不同生物学的机制基础仍不清楚。p53可诱导不同的反应,根据细胞类型和刺激产生不同的生物学结果。
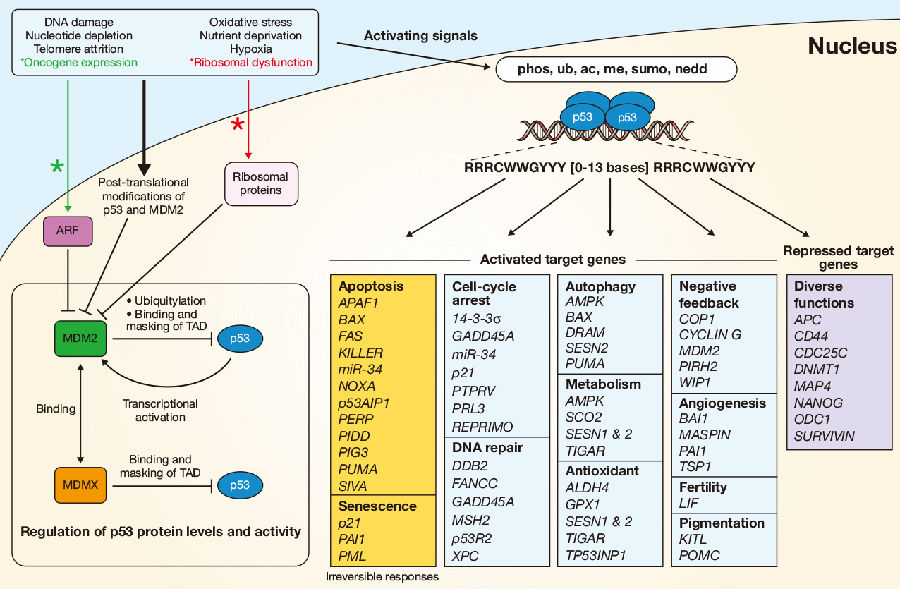
p53不仅仅是一个“开关”转换,还会对复杂的细胞信号作出反应,激活后协调适应细胞类型及培养条件。同样的细胞类型、表观遗传状况、微环境、激活信号等对于p53的生物活性及应答都有重要影响。
TP53基因突变多样性造成不同影响
正如我们对p53生物学功能的理解一样,TP53基因突变如何促进癌症的观点复杂。最常见表征是错义突变,意味着p53的对肿瘤抑制是至关重要的。一般将p53分类为野生型或突变型,但TP53突变以不同模式、不同突变和许多产生显著功能和表型分枝的等位基因构型发生。
成千上万的肿瘤的基因组测序已经证实,大约一半的癌症具有TP53突变,尽管突变的频率和分布在肿瘤类型之间可以显着不同。在癌症中观察到的大多数TP53单核苷酸变体(SNV)是错义突变。出乎意料的是,将近25%的TP53突变是预测编码截短蛋白的无义或移码突变,而其余部分由剪接位点SNV和框架内不明确的生物学意义组成。
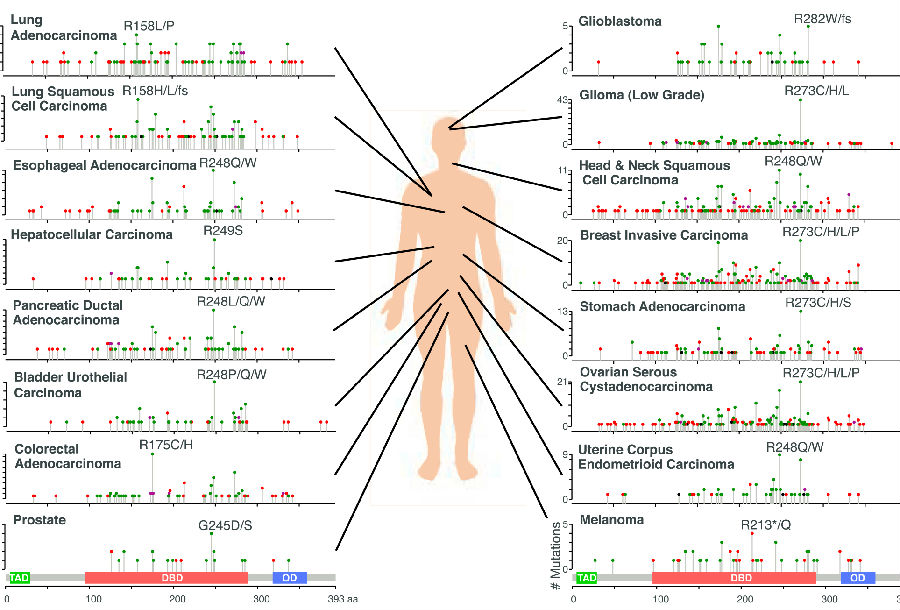
实验数据显示某些突变型TP53等位基因具有“功能获得”性质,其产生不同于无效型的表型。可以反映功能的衰减、分离或者新功能。野生型功能的减弱,可以产生同形态,也可以产生不可预测的表型,这取决于p53抑制的水平。例如,具有不同敲减效率的p53靶向shRNA显示不同的破坏p53效应子功能和驱动小鼠淋巴瘤形成的能力,只有完全p53缺失能够引发染色体不稳定性。鉴于大多数突变体不能诱导细胞凋亡,功能丧失是所有癌症相关p53突变体的共同特征。如上述细胞凋亡缺陷型p53R175P等位基因所例示的,功能的分离(p53突变体可保留一些但不是全部的相互作用)也是可能的。最后,还描述了一系列的neomorphic突变体活动。实际上,癌症中遇到的突变获得了这些独立特征的某些组合。虽然p53突变体通常按其对结构的影响进行分类,即干扰DNA结合的“接触”突变体和失去适当折叠的“构象”突变体,但目前不可能准确预测特定突变如何影响功能。
近30年的科学研究已经证明了p53在细胞应激反应中重要作用,已经被越来越多的研究人员用来研究癌症发展,其详细的特征描述加深对基因调控机制和自然对抗癌症保护机制的了解。当然这也是一个精致而复杂的肿瘤抑制过程,涉及到一系列生物反应。一方面,p53在DNA损伤后阻止或消除细胞的能力表明它可以通过防止致癌突变的积累来预防癌症。另一方面,p53响应于异常癌基因表达而阻止增殖的能力表明在限制致癌突变的后果方面发挥作用。
虽然关于p53的大量研究,有时是矛盾的,但现在非常清楚的是,细胞对p53激活的反应涉及激活触发、细胞谱系和细胞状态之间复杂的相互作用。尽管p53的这种依赖效应阻碍了p53介导的肿瘤抑制机制的推广尝试,但它们提供了利用癌细胞网络的机会,同时避免了在所有组织中操纵p53的有害后果。在未来面临的一个挑战将是从这些大量的研究中提取真理将p53转化为临床应用。已有数据表明TP53突变型癌症将导致超过5亿人死亡。
参考文献:
1. Best of Cell 2017
2. EdwardR. Kastenhuber, Scott W. Lowe. Putting p53 in Context. Cell 170, 1062-1078
3. Abegglen,L.M., Caulin, A.F., Chan, A., Lee, K., Robinson, R., Campbell, M.S., Kiso,W.K., Schmitt, D.L., Waddell, P.J., Bhaskara, S., et al. (2015). Potential mechanismsfor cancer resistance in elephants and comparative cellular response to DNAdamage in humans. JAMA 314, 1850–1860.
4. Ablain, J., Rice, K., Soilihi, H., deReynies, A., Minucci, S., and de The´, H. (2014). Activation of a promyelocyticleukemia-tumor protein 53 axis underlies acute promyelocytic leukemia cure.Nat. Med. 20, 167–174.
5. Achatz, M.I., and Zambetti, G.P. (2016).The inherited p53 mutation in the Brazilian population. Cold Spring Harb.Perspect. Med. 6, 6.
7. Alexandrov, L.B., Nik-Zainal, S., Wedge,D.C., Aparicio, S.A., Behjati, S., Biankin, A.V., Bignell, G.R., Bolli, N.,Borg, A., Børresen-Dale, A.L., et al.; Australian Pancreatic Cancer GenomeInitiative; ICGC Breast Cancer Consortium; ICGC MMML-Seq Consortium; ICGCPedBrain (2013). Signatures of mutational processes in human cancer. Nature500, 415–421.
8. Alexandrov, L.B., Ju, Y.S., Haase, K.,Van Loo, P., Martincorena, I., Nik-Zainal, S., Totoki, Y., Fujimoto, A.,Nakagawa, H., Shibata, T., et al. (2016). Mutational signatures associated withtobacco smoking in human cancer. Science 354, 618–622.