不少人对抗肿瘤药物筛选的方法感兴趣,上期我们一起学习了化合物筛选方法,本期我们再介绍基于细胞功能学的体外抗肿瘤化合物的筛选方法。
一、非靶点研究的抗肿瘤化合物筛选策略
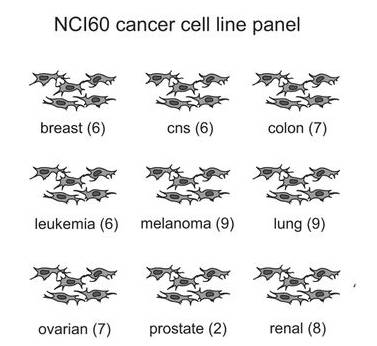
自从上世纪80年代,美国国家癌症研究所(National Cancer Institute, NCI) 逐渐建立起基于NCI-60细胞的抗肿瘤化合物体外筛选模式,是临床前筛选抗肿瘤先导化合物的有效方法。具有简单、直接、快速的优点。
最常用的技术是进行化合物在细胞水平的功能学实验,如:细胞增殖、细胞转移、血管形成抑制实验等。
1细胞增殖
细胞增殖是指细胞在周期调控因子的作用下,通过DNA复制、RNA转录和蛋白质合成等复杂反应而进行的分裂系列过程。细胞通过分裂的方式增殖,细胞增殖是生物体的重要生命特征。单细胞生物以细胞分裂的方式产生新个体,多细胞生物以细胞分裂的方式产生新的细胞,从而补充体内衰老和死亡的细胞。细胞增殖的同时,在细胞群体中总有一些因各种原因而死亡的细胞,活细胞在总细胞中所占的百分比叫做细胞活力。
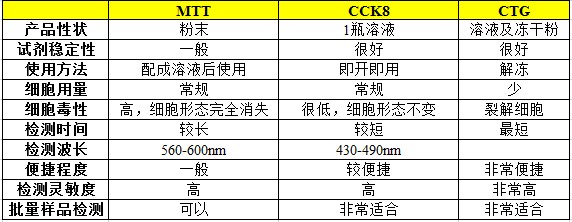
检测细胞存活与增殖的方法主要包括观察DNA合成含量和检测细胞代谢活性两种,前者主要是DNA前体物质(胸腺嘧啶核苷类似物)掺入法,比如BRDU、EDU法;后者主要为MTT、XTT、MTS、CCK-8、WST-1及WST-8法等,在后者中现在最主流的就是CTG法。
细胞增殖实验是化合物体外功能学筛选试验中的基本实验,在进行细胞增殖实验后,也会进一步验证化合物对细胞转移、血管形成的影响。
2细胞转移
细胞转移实验有细胞划痕、transwell迁移与侵袭实验。
3血管形成
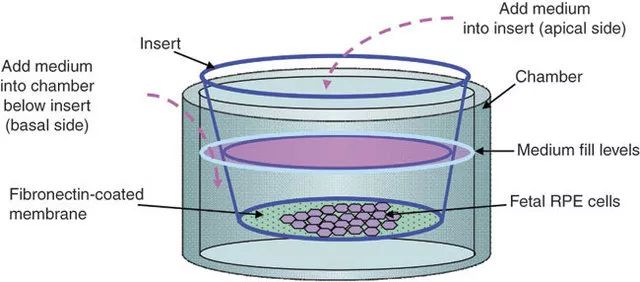
血管形成在细胞水平的实验有HUVEC血管形成实验。
二、基于靶点的抗肿瘤药物筛选
靶点药物市场占有量
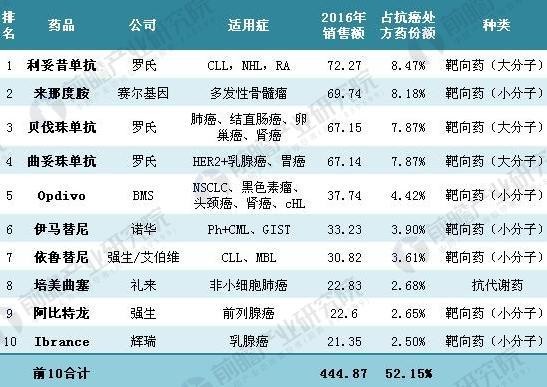
根据美国FDA药品评价和研究中心(CDER)公布信息显示,自1997年第一个靶向抗肿瘤小分子获批以来,至2016年已有72个靶向抗肿瘤药物被批准,其中小分子制剂已达到30多个。另外根据前瞻产业研究院发布的《2018-2023年中国生物医药行业市场前瞻与投资战略规划分析报告》数据显示,2016年全球前10大抗肿瘤药占抗癌处方药份额为52.15%,其中大分子药物占24.21%(3种),小分子药物占27.94%(7种)9种药物是靶向药物。
热门靶点情况
抗肿瘤靶向药物是近15年来脱颖而出的作用机制独特的药物,自从以酪氨酸激酶抑制剂(替尼类)代表的药物格列卫一战成功后,研发管线中的新产品接二连三地进入临床,上市后的品种也取得了优异的销售业绩,销售额每年过千亿。因为靶向药物的优势和巨大的市场前景,靶向药物受到各类研究机构和药物开发公司的关注。根据已上市与在研的靶向抗肿瘤药物整理最热门的靶点如下:
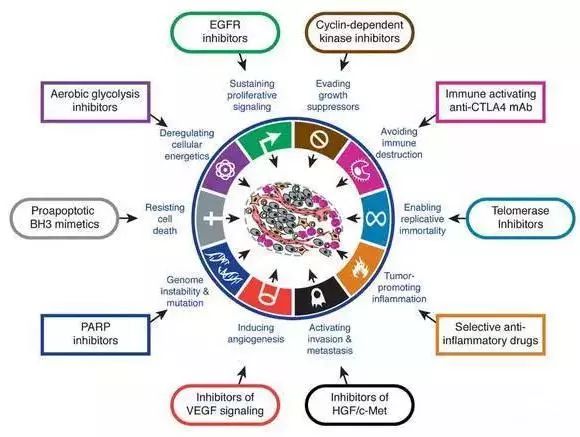
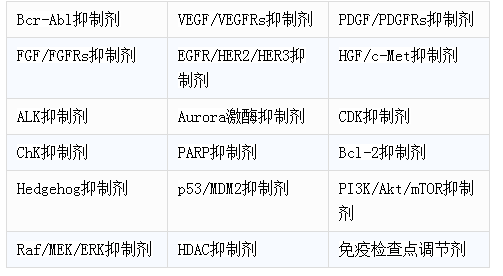
受体酪氨酸激酶靶点当属头号热门,如Bcr-Abl、VEGF/VEGFRs、PDGF/PDGFRs、EGFR/HER2、ALk已有多个药物上市,目前肿瘤信号网络中,FGFR、c-Met、HER3、Hedgehog等靶点吸引了不少的研究,但最热的当是PI3K/Akt/mTOR、Raf/MEK/ERK两条细胞内信号通路。2013年FDA批准了BTK抑制剂ibrutinib,对CLL的疗效很好,吸引了一些药企开发me-too/me-better药物。涉及细胞周期调控的靶点如Aurora激酶、CDK、ChK也有不少新药在研,最耀眼的无疑是CDK4/6抑制剂,已经有三个分子推进到后期开发,而Aurora激酶和ChK抑制剂则大多在早期临床失败。针对DNA损伤修复的PARP的药物研发也回暖,而针对蛋白-蛋白相互左右的新靶点如Bcl-2、MDM2、IAP也有多个分子进入临床研究。特别值得一提的是表观遗传调控剂,早年发现的阿扎胞苷、地西他滨等被证明为DNA甲基转移酶抑制剂,目前研究得最多的是HDAC抑制剂,表观遗传的其他靶点如组蛋白赖氨酸甲基转移酶EZH2、组蛋白H3甲基转移酶DOT1L、溴结构域蛋白BET等也开展了大量基础研究。近来抗癌领域最耀眼的无疑是免疫疗法,调节CTLA4、PD1/PDL1、4-1BB、OX40、CD27等免疫检查点可以激活T细胞免疫应答,而基因工程修饰的CAR、TCR T细胞的应用更是标志着个性化免疫治疗时代的到来。
靶点药物筛选实验方法
基于靶点开发的药物或者需要寻找作用靶点的药物,一般策略是先进行体外靶点验证试验。目前主要研究的靶点可分为4大类:

G蛋白偶联受体
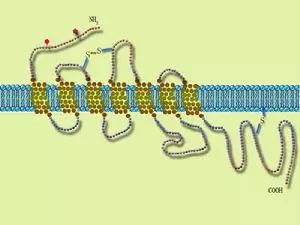
G蛋白偶联受体(GPCRs)是一种与三聚体G蛋白偶联的细胞表面受体。含有7个穿膜区,是迄今发现的最大的受体超家族,其成员有1000多个。与配体结合后通过激活所偶联的G蛋白,启动不同的信号转导通路并导致各种生物效应。
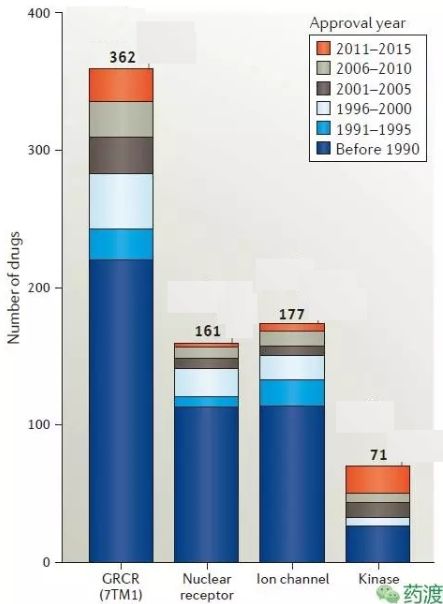
G蛋白偶联受体是研究最多的药物靶点,主要是由于它们大量参与了人类的病理生理及药理活动。根据对所有GPCR药物在临床试验中的最新分析,我们发现有475种药物(约占FDA批准药物的34%)作用在108个独特的GPCRs靶点上。目前临床试验中约有321种药物,其中20%是作用于尚未有批准上市药物的66种潜在新型GPCR靶标,其中生物药、变构调节剂和偏向激动剂的数量有所增加。GPCR调节剂的主要适应症为糖尿病、肥胖和阿尔茨海默病,还有几种中枢神经系统疾病。
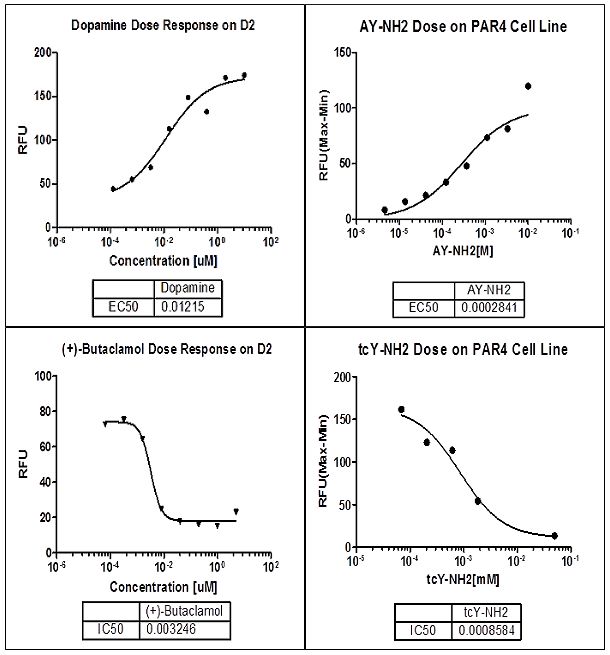
目前常用的检测方法是进行cAMP和Ca2+试验,分析药物对靶点的激活或抑制作用。
离子通道
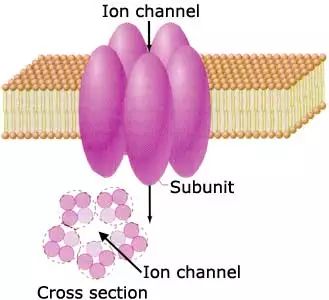
离子通道由细胞产生的特殊蛋白质构成,它们聚集起来并镶嵌在细胞膜上,中间形成水分子占据的孔隙,这些孔隙就是水溶性物质快速进出细胞的通道.离子通道的活性,就是细胞通过离子通道的开放和关闭调节相应物质进出细胞速度的能力,对实现细胞各种功能具有重要意义。
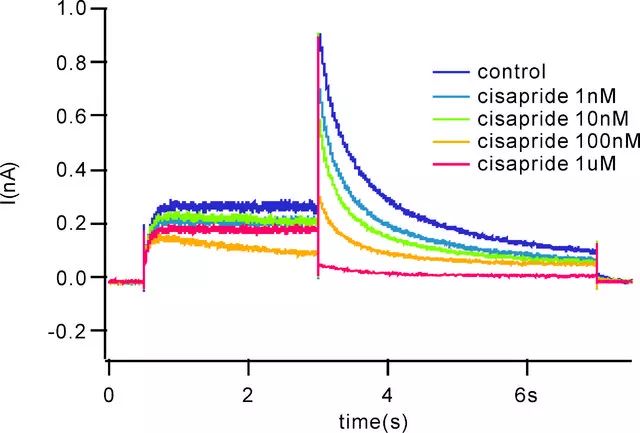
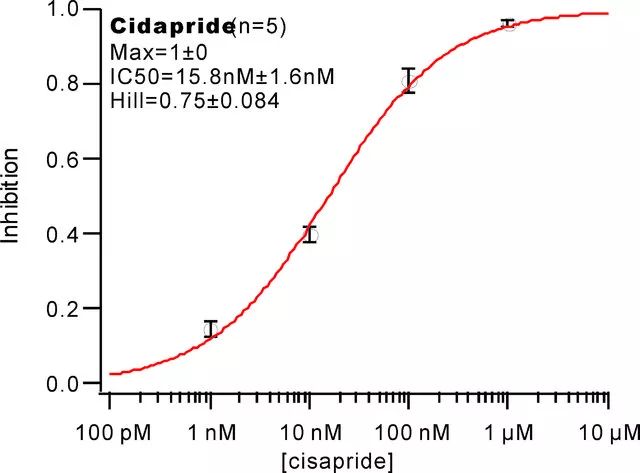
目前检测的方法主要是膜片钳技术。
核受体
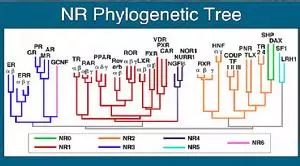
核受体超家族(nuclear receptor superfamily)是一组配体(包括固醇类激素、维生素D、蜕化素、9-顺式和全部反式视黄酸、甲状腺激素、脂肪酸、氧化甾醇、前列腺素J2、白三烯B4、法呢醇代谢产物等)激活的转录因子家族,通过在信号分子与转录应答间建立联系,调控着细胞的生长和分化。在人类,核受体家族包含48个成员,例如PPAR、FXR、LXR、VDR、RXR等。
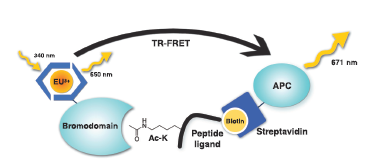
目前常用的检测方法有TR-FRET(荧光共振能量转换法)、Cell-based assay。TR-FRET是一种利用长荧光寿命的荧光基团使得检测时间延长到50-150ms的方法。这种时间延长使得信号脱离大部分的短期杂散光干扰。
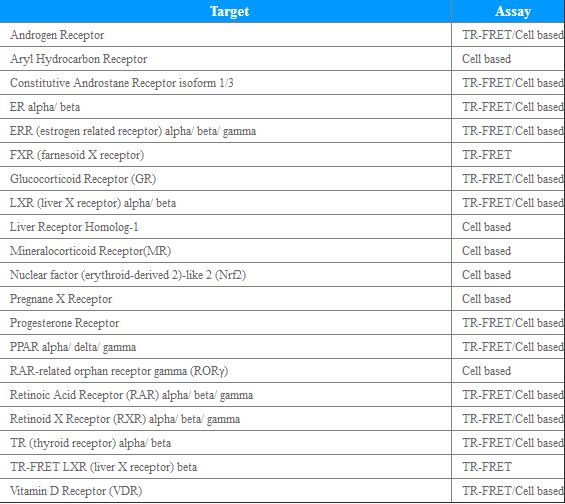
激酶
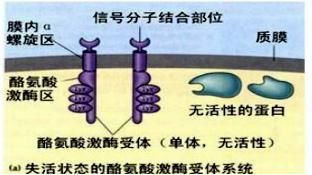
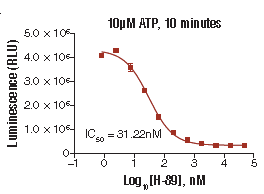
激酶(kinase)是一类生物化学里的分子,从高能供体分子(如ATP)转移磷酸基团到特定靶分子(底物)的酶,这一过程谓之磷酸化。最大的激酶族群是蛋白激酶。 蛋白激酶作用于特定的蛋白质,并改变其活性。这些激酶在细胞的信号传导及其复杂的生命活动中起到了广泛的作用。蛋白激酶(Kinase)是细胞生命活动重要的信号使者,可催化将ATP末端的γ-磷酸基团转移至底物上,能催化多种底物蛋白质酪氨酸残基磷酸化,从而传递信号,在细胞增殖、存活、凋亡、代谢、转录以及分化中具有重要作用。其中蛋白酪氨酸激酶是目前抗肿瘤靶向药物研发中最为理想的“靶点”,超过50%的原癌基因和癌基因产物都是酪氨酸激酶。它们的异常表达通常导致细胞增殖调节发生紊乱,致使肿瘤发生,并与肿瘤的侵袭、转移、肿瘤新生血管生成以及肿瘤的化疗抗药性密切相关。近年来研发的绝大多数靶向抗肿瘤药物为酪氨酸激酶抑制剂,目前小分子激酶抑制剂已成为药物研发的一个热点领域。
目前使用较为广泛的检测方法是基于试剂盒的ADP-Glo法。