(一)
世界上第一个针对癌细胞基因突变的靶向药物是啥?
2001年上市的格列卫。
目前长期疗效最好的靶向药物是啥?
还是2001年上市的格列卫。
它针对的是白血病特有的BCR-ABL融合突变基因。单凭这一个药,就让慢粒白血病患者五年存活率从30%一跃到了90%。
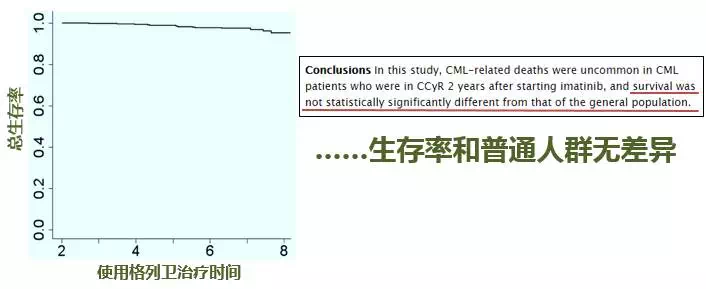
不仅如此,长期跟踪结果显示,如果用药2年后癌细胞检测不到的话,患者8年生存率高达95.2%,和普通人群无统计学差异,死亡的4.8%里多数为意外,和癌症无关。
所以,格列卫是当之无愧的“神药”。
但回头来看,这其实非常奇怪!因为几乎其它所有的靶向药物,都面临一个巨大挑战:耐药性。
肺癌里的EGFR靶向药物,ALK靶向药物,黑色素瘤的BRAF靶向药物,通常一开始疗效都非常好,但几乎无一例外会出现抗药性:由于肿瘤出现新的突变,靶向药物失效。因此,通常单凭一个靶向药物,很少能让患者长期生存。
格列卫例外。
虽然也有患者对格列卫产生耐药性,但相对别的靶向药物比例低很多。大量患者仅仅依靠这一种靶向药物,就把癌症变成了慢性病。
为什么呢?
(二)
格列卫上市后,还有很多科学家在继续研究它,但其中两个研究结果,让大家很迷茫。
结果1:格列卫其实无法杀死所有BCR-ABL突变白血病细胞。有些癌细胞对格列卫不敏感。
结果2:有些患者使用格列卫一段时间后,由于种种原因停药。但这些患者仍有很大比例长期存活,癌症不复发。
1和2放在一起,非常不合理。如果格列卫不能杀死所有癌细胞,那么停药后肯定会复发。除非人体内有什么玩意儿在停药后还能继续杀伤癌细胞?
后续的两类研究提供了线索:
结果3:使用过格列卫后,患者体内针对癌细胞的免疫细胞数量大大增加。
结果4:在老鼠模型中,如果剔除免疫细胞,格列卫疗效大打折扣,癌症复发频繁,无法长期存活。
3和4放在一起,得出了一个意外,但非常重要的结论:
格列卫能激活免疫系统对抗癌细胞!
这绝对是无心插柳。
研发格列卫的时候大家一心只想把癌细胞弄死,没人关心免疫系统。这个药上市产生特别好的疗效,大家理所应当认为主要因为药物能很好地抑制BCR-ABL突变基因,从而彻底杀死白血病细胞。
但显然,除了能特异杀死大量癌细胞以外,格列卫还能同时激活对抗癌细胞的免疫系统。
靶向+免疫,双剑合璧,所以格列卫才成为了“神药”。
当然,格列卫耐药比例远低于其它靶向药物,其中的原因很可能不止一个,包括血液中药物分布更均匀,慢粒癌细胞生长比较缓慢,癌细胞本身的异质性更低,等等。但免疫细胞能干掉残余癌细胞,肯定是阻止癌症复发,让患者长期生存的最大功臣之一。
人类开发出来的第一个针对癌细胞突变的靶向药物,居然意外也是个免疫药物。
瞎猫撞上死耗子。但无所谓,因为某四川的前辈说过:不管黑猫白猫,抓住老鼠就是好猫。
药嘛,好用就行。
(三)
格列卫的故事并不是个案,随着对癌症和免疫系统关系的研究越来越多,我们发现不少靶向药物其实也能影响免疫系统,也是免疫药物!
不信咱们再来看另一个例子。
黑色素瘤,有很多由于BRAF基因突变导致,因此药厂开发了针对BRAF突变的靶向药物,目前上市的有俩,Zelboraf和Tafinlar。
这俩BRAF靶向药物效果都不错,把患者2年生存率从15%提高到了38%。和格列卫故事类似,大家都以为这俩药物作用机理就是抑制突变的BRAF基因,杀死癌细胞。但某一天,几个科学家灵光一现,说咱们看看用药前后,肿瘤里的免疫细胞情况吧?
结果他们被震惊了!

大家可以明显看到,用药前,黑色素瘤里主要是癌细胞(一个蓝色小点就是一个癌细胞),少数免疫细胞(棕色)或许有心杀敌,但力量对比悬殊,显然力不从心。但使用BRAF靶向药物后,大量免疫细胞进入肿瘤,包围癌细胞,准备作战。
因此,BRAF靶向药物,除了直接杀死黑色素瘤细胞,还能发出信号,召唤免疫细胞进入肿瘤。
这其中的原理到目前还不是完全清楚,但毫无疑问,和格列卫一样,这个靶向药物,也同时是免疫药物。同样是无心插柳,同样是瞎猫撞上死耗子。
但还是无所谓,因为某四川的前辈说过:不管黑猫白猫,抓住老鼠就是好猫。
药嘛,好用就行。
(四)
故事到这里并没有结束,由于这个研究,大家后来陆续发现有其它靶向药物也有类似功能,能把免疫细胞引入肿瘤。这类靶向药物可以称为“促免疫型靶向药物”。
但遗憾的是,单靠吸引免疫细胞进入肿瘤还不够,很多免疫细胞进入肿瘤后,马上进入“吃瓜群众”模式,只围观,不杀敌。其中一个重要原因是癌细胞已经进化出了“免疫抑制”功能,会伪装,告诉免疫细胞“兄弟,自己人,别K我”。
遇到这种骗子,咋办?
别着急,最近出现的新型免疫药物,比如PD1(或PD-L1)抑制剂,其作用就是揭开癌细胞伪装,让免疫细胞开始攻击。
理论上,“促免疫型靶向药物联合免疫疗法”的混合疗法效果应该不错。前者把免疫细胞引入肿瘤,后者让免疫细胞开始攻击。
这幅画面,想想就让人觉得兴奋。
最近,结直肠癌中首先出现了成功的苗头, 在一个小型1期临床试验中(编号NCT01988896),患者使用“促免疫型靶向药物Cobimetinib”联合“PD-L1抑制剂 Atezolizumab”的混合疗法后,实现了17%肿瘤缩小率,和39%疾病控制率(缩小+稳定)。
这个结果非常让人兴奋,因为历史结果显示,参与这个临床试验的这些患者,如果单用免疫疗法,肿瘤缩小的几率几乎为0。而现在,促免疫型靶向药物,让他们开始响应免疫疗法。
理论上,所有促免疫性靶向药物,都能对免疫疗法产生不同程度的积极推动作用,两种药物联合使用,效果可能很不错。很期待大规模临床试验来证明这样的猜想。
要说明的是,并不是所有靶向药物都能激活免疫系统,甚至有些明显是抑制免疫反应的。现在,研究各个靶向药物对免疫系统的影响是最热门的研究方向之一。
(五)
“促免疫型靶向药物”和“免疫疗法“联合使用有双重意义。一方面,利用免疫疗法来降低靶向药物耐药的可能,另一方面,利用靶向药物来增强免疫疗法的效果。
不管靶向药物,还是免疫药物,有效的就是好药,但我们真正寻找的,是最好的混合疗法。
就像虽然黑猫,白猫,抓住老鼠就是好猫,但我们最喜欢的其实还是那个胖乎乎的黑白混合猫!

努力吧,各位!
本文目测可插入“成都大熊猫基地”,“白加黑感冒药”,“白猫洗衣粉”等广告......欢迎各公关公司联系:)
本文首发于微信公众号“菠萝因子”。
健康君编辑 | miffyyz
参考文献
1:Immunological off-target effects of imatinib. Nat Rev Clin Oncol. 2016 Jul;13(7):431-46.
2:Imatinib potentiates antitumor T cell responses in gastrointestinal stromal tumor through the inhibition of Ido. Nat Med. 2011 Aug 28;17(9):1094-100.
3:Multicenter Independent Assessment of Outcomes in Chronic Myeloid Leukemia Patients Treated With Imatinib. J Natl Cancer Inst. 2011 Apr 6;103(7):553-61.
4:BRAF Inhibition Is Associated with Enhanced Melanoma Antigen Expression and a More Favorable Tumor Microenvironment in Patients with Metastatic Melanoma. Clin Cancer Res. 2013 Mar 1;19(5):1225-31.
5:Clinical activity and safety of cobimetinib (cobi) and atezolizumab in colorectal cancer (CRC). 2016 ASCO Annual Meeting
6:Targeted Therapy and Checkpoint Immunotherapy Combinations for the Treatment of Cancer. Trends Immunol. 2016 Jul;37(7):462-76.
封面和文内图片来自作者编译。