
新生儿微生物群的定殖受很多因素影响,包括出生前的子宫环境、出生时的分娩方式、出生后的抗生素治疗、饮食等等。这些因素引发的微生物群紊乱会引发免疫系统紊乱,从而导致疾病的发生。因而,幼儿时期被称为微生物定植的“窗口期”。
近期,《Nature medicine》期刊发表一篇综述,重点论述这些关键因素如何影响微生物、免疫系统,并讨论了以调节微生物平衡为靶向的疾病治疗策略。
婴幼儿微生物定殖的影响因素
综述列举了包括剖腹产、抗生素治疗、益生菌、营养补充剂、宠物等因素对于婴幼儿微生物平衡的影响,并指明这些因素可能引发的疾病类型和相关风险:
产前因素:
子宫是否无菌?答案是否定的。
科学家在胎盘、羊水、胎膜、脐带血、胎便组织中均检测到了微生物,例如肠球菌、链球菌、葡萄球菌、丙酸菌、双歧杆菌和乳酸菌。有研究认为,孕妇的肠道微生物会通过血液转移至胎儿。同时,胎盘中的微生物丰度很低,且种类都是类似于口腔中的非致命细菌。所以科学家们推测,孕妇口腔中的细菌也会随着血液循环传递至胎儿。
出生方式:
伴随着出生,婴儿开始真正接触外界微生物。不同的分娩方式成为影响婴儿微生物建成的首个因素。
怀孕会改变阴道微生物,使其丰度较低、稳定性较佳。所以顺产的婴儿,他们的皮肤、肠道、口腔、鼻咽腔会富含乳酸杆菌,类似于孕产妇阴道微生物群。相反,剖腹产出生的婴儿,他们微生物组缺乏乳酸杆菌,更多的是含有普通皮肤、外界环境的微生物,例如葡萄球菌、链球菌和丙酸杆菌。
尽管两种出生方式引发的最初差异会逐渐消减,但是剖腹产带来的微生物印记会持续至1—2岁。这意味着,剖腹产会延迟婴幼儿肠道微生物结构的进化,但是这是否与相关疾病有关联,目前还没有定论。
抗生素:
抗生素使用过度一直是个问题。儿童服用抗生素类药物会干扰体内微生物组结构。生命初期过量使用抗生素也会增加患病的风险,例如哮喘、2型糖尿病、炎性肠病(IBD)以及牛奶过敏。
抗生素与疾病之间并不是直接的因果关系。现有的研究表明,相比于其他儿童,婴幼儿时期接触抗生素的孩子更容易被感染。抗生素对微生物组造成的变化,取决于身体组织、抗生素种类和使用量。这些因素对婴幼儿健康的影响,研究还甚少。
小鼠模型研究为我们了解微生物群如何被抗生素干扰提供了可能。科学家发现,早期接触抗生素会降低乳杆菌、分节丝状菌、支原体Allobaculum等肠道有益菌类,从而增加过度肥胖、代谢异常的风险。抗生素会干扰微生物组平衡,包括细菌、病毒和真菌。此外,新生小鼠如果注射抗生素会增加过敏概率。
饮食:
婴儿出生之初的营养多吸收自母乳或者婴儿乳品。其中,母乳喂养是为婴儿提供健康成长和发育所需营养的理想方式。
越来越多的证据证实,母乳中富含免疫球蛋白A、乳铁蛋白、防御素等有益物质,能够增强新生儿的免疫力、智力、减少患病率和死亡率等等。同时,坚持母乳喂养的产妇本身患高血压、高脂血症、心血管疾病以及2型糖尿病的概率也会大大降低。
母乳中的糖蛋白能够为婴儿肠道菌提供能源,有着抵御肠道病原微生物感染、维持肠道生态平衡的双重作用,有利于婴幼儿生长发育。此外,母乳中也含有丰富的细菌,例如葡萄球菌、链球菌、乳酸菌和双歧杆菌。
随着年龄增长,3岁的幼儿已经拥有成熟的微生物组。
益生菌和膳食补充剂:
益生菌是一类对宿主健康有益的活性微生物,而益生元作为膳食补充剂,有利于有益微生物的生长。婴儿的配方奶中添加益生菌/益生元越来越普遍,尽管并没有有力的数据证实其确实有效。
对于儿科疾病而言,例如过敏、肥胖、胃肠道感染,益生菌起到什么作用呢?有研究证实其确实有利于婴幼儿健康,也有数据表明两种之间并没有显著促进作用……科学家一直未能得出统一的结论。
这意味着,对于益生菌之类的膳食补充剂是否有益于婴幼儿健康的研究需要考虑其肠道菌群组成的个体差异。
环境因素:
不同的环境也会影响新生儿微生物的定殖。这里的环境因素包括身体接触的物件、呼吸的空气。值得注意的是,这些共生微生物同时存在于婴儿及其母亲身上,表明早期接触特定的菌株会构成长期的寄居关系。
有研究推测,幼儿时期接触宠物、动物会增加宝宝接触微生物的机会,微生物多样性的增加会增强其免疫力。出生后的2个月内,成长在更大、内毒素含量更高的房屋内会增加婴幼儿体内双歧杆菌的丰度,同时降低乳酸菌、艰难梭状芽胞杆菌的聚集。
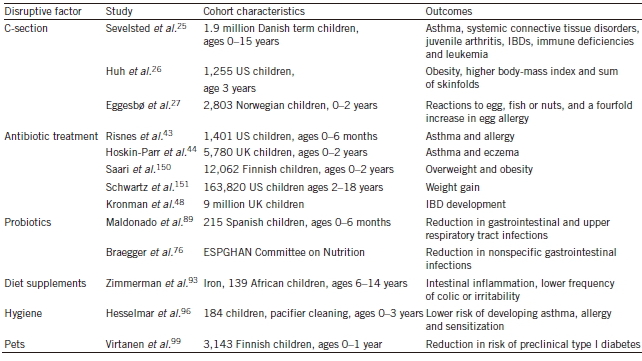
流行病学研究建立了一个关联图,揭示各时期影响微生物组的因素:
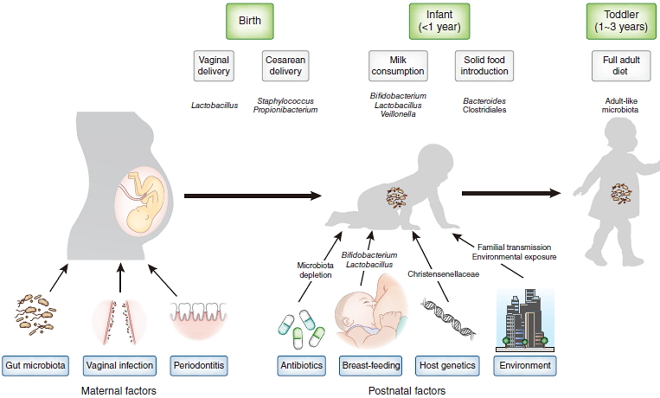
出生前:孕产妇阴道感染或者牙周炎会导致细菌入侵子宫。母亲的肠道和口腔微生物组能够通过血液传递至胎儿;出生时:宝宝的出生方式也会影响其微生物组成;出生后:包括抗生素治疗、母乳及辅食、婴儿基因、接触环境都会影响婴幼儿(<1岁)体内微生物结构的平衡。伴随着成长,幼儿的饮食结构会多样化,他们的微生物群会趋向成熟。
肠道微生物对免疫系统的影响
婴幼儿肠道微生物与免疫系统之间的互作平衡是抵抗病原体入侵、阻止炎症发生的关键。多篇研究已经证实,患有慢性促炎症的幼儿之后出现肥胖、IBD、牛皮癣的风险会增加。包括派尔集合淋巴结、肠系膜淋巴结在内的二级淋巴结构在出生之前发育形成,而肠道微生物群的定殖是在出生后与免疫系统互作过程中完成的。
幼儿肠道微生物与免疫系统之间有着深远的关系,具体如下图:
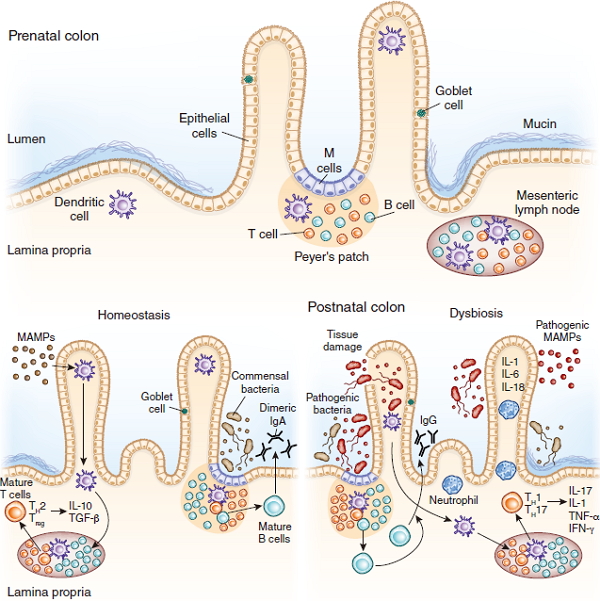
扁平细胞(M细胞)是一种抗原转运细胞,散布于肠道粘膜上皮细胞间,负责将抗原由肠腔转运至上皮下的淋巴细胞,启动免疫应答反应。树突状细胞(DCs)是专职抗原呈递细胞,通过呈递抗原促使T细胞依赖性B细胞成熟,并分泌二聚体免疫球蛋白(dimeric IgA)。IgA是抵抗病原体的关键蛋白。细菌也可以直接被DC细胞胞吞,投递给肠系膜淋巴结中的T细胞,促使T细胞分化。
左下图:平衡环境中,微生物相关分子(microorganism-associated molecular Pattern,MAMPs)会协同共生微生物调节细胞因子的产生,促进DC细胞呈递启动调节性T细胞分化的信号,并分泌IL-10。
右下图:在失衡环境下,微生物组成紊乱导致病原体增加。致病性MAMP分子会迫使上皮细胞分泌促炎症因子(IL-1, IL-6 and IL-18),促进效应T细胞分化成CD4+ TH1、 TH17细胞,这两类T细胞会分泌促炎症因子,例如IL-17,肿瘤坏死因子(TNF-a)。这些促炎症因子会诱导中性粒细胞保护宿主免受病原体感染。
靶向微生物的疾病治疗策略
新生儿微生物群异常与多种疾病有关联,例如哮喘、过敏、肥胖等等。如何防治这些疾病?科学家提出,通过饮食、抗生素等干预措施调整微生物群,以实现预防、治疗疾病的目标。
疾病发展阶段不同,对应的微生物治疗策略也不同:
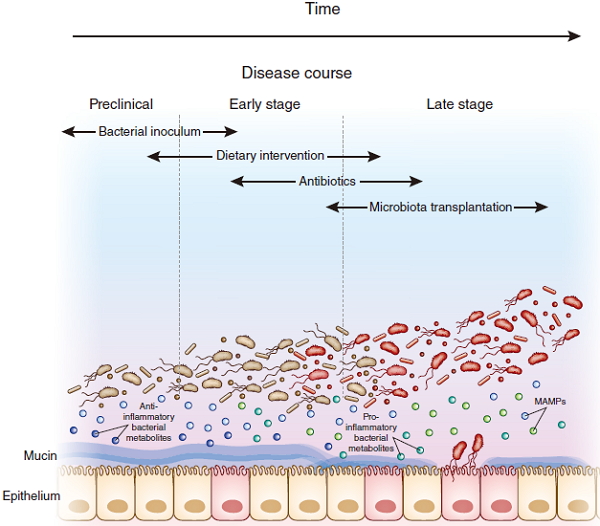
在临床前阶段,疾病症状尚未明显,但是微妙的生理变化已经发生。利用细菌培养液可能是阻止疾病继续恶化的有效方法;随着病情发展,体内微生物群失衡,导致致病病原体增加,引发炎症反应。保护上皮组织的黏液层会因为疾病加重而变薄。这一阶段多采用饮食干预、抗生素进行治疗;疾病后期,致病菌会伺机突破上皮障碍,病情加重。这时候,更强烈的抗生素以及粪便微生物移植有望恢复微生物群平衡。
目前,以微生物群为靶向的治疗策略大致被分为3大类:
1) 削减。例如,抗生素常常用于降低肠道微生物组成。对于小儿炎症性肠病,医生的处方常常包括抗生素及其组合。但是抗生素的长期使用又会增加幼儿患其他疾病的风险。这是一把双刃剑,如何把握有效的剂量很重要。
2) 调整。研究人员建议利用饮食干预的方法,饿死有害的细菌或者促进有益微生物生长。例如,特殊的肠内营养(EEN)则是一个典型,通过专门的液体营养剂取代正常的饮食给患儿服用。EEN是治疗小儿克罗恩氏病的第一道治疗策略。
3) 取代/修复。高度共生的环境可能意味着我们需要更极端的方式去重塑微生物群。粪便微生物移植(FMT)方法则希望通过外源微生物取代原有的微生物群,科学家希望它可以治疗艰难梭菌感染(CDI)以及溃疡性结肠炎。
鉴于肠道微生物对婴儿健康的重要性,所以旨在调整微生物群体内平衡的预防性治疗是非常可取的。但是,治疗营养不良的研究却证实,目前的饮食干预并不能有效将肠道微生物恢复至健康状态。科学家们仍然需要投入大量工作验证不同的饮食结构如何影响微生物组成。
备注:文章编译、整理自Nature Medcine综述“The microbiome in early life: implications for health outcomes”,图表截取自文章。







