从蛋白质结构与功能的基础研究到功能性蛋白质表达与纯化工艺的开发,亲和标签已经成为重组蛋 白纯化的一个重要且有效的工具。它们不仅便于对融合蛋白的检测与纯化,而且可能对目标蛋白的理化性质产生有利的影响,可以提高重组蛋白的产量,增强重组蛋 白的可溶性,促进重组蛋白的正确折叠。
目前广泛应用的亲和标签
自 从20 世纪70 年代中期融合标签技术出现以来,亲和标签已成为一种重组蛋白纯化十分有效的工具,具有结合特异性高、纯化条件温和、纯化步骤简便、适用性广泛等显著优势。 通常,亲和标签定义为对特定的生物或化学配基具有高度亲和力的一段氨基酸序列。到目前为止,已经出现了种类众多、功能各异、用途多样的亲和标签( 表1) ,极大地促进了对重组蛋白的有效纯化。
根据自身分子量大小的不同,亲和标签可以分 为两大类: 一类是结合固定化配基的短肽标签,如Histag、FLAG-tag、Strep-tagⅡ等; 另一类是识别小分子配基的蛋白标签,如GST、MBP 等。而根据结合配基分子量大小的不同,亲和标签也可以分为两大类: 一类是与小分子配基结合的短肽或蛋白标签,如结合固定化金属的His 标签、结合固定化谷胱甘肽的GST 标签等; 另一类是与蛋白配基结合的短肽标签,如结合固定化钙调蛋白的CBP 标签等。
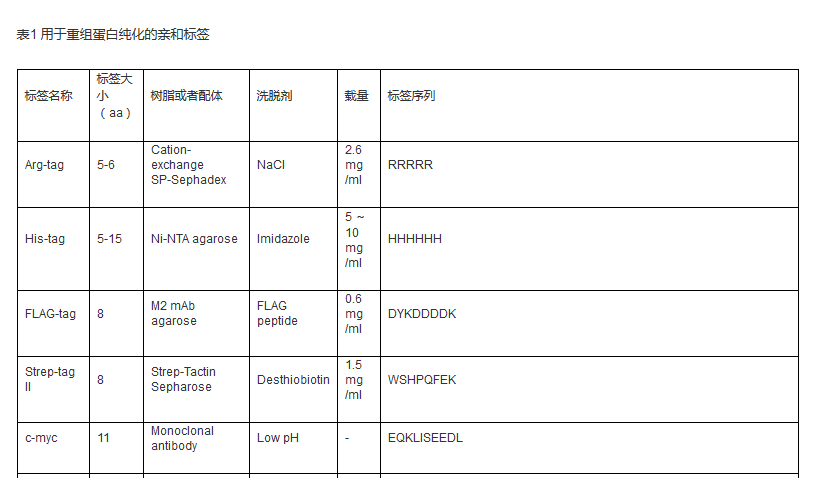
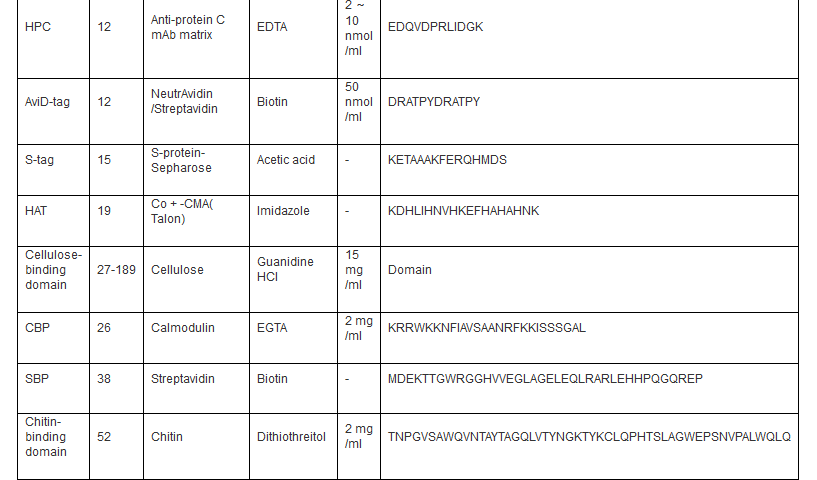
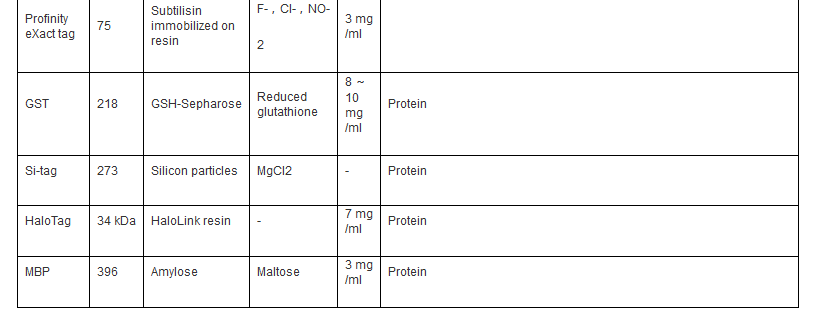
自 从上世纪70 年代中期亲和标签融合技术出现以来,多种多样的短肽或蛋白亲和标签极大地方便了外源表达重组蛋白的分离与蛋白质复合体的纯化,已成为蛋白质研究领域不可或 缺的工具。一般而言,一个完美的亲和标签应该具备以下特性: ( 1) 能够用于纯化任何表达宿主或表达系统所表达的重组蛋白; ( 2) 可以位于目标蛋白的任意位置而不影响其结构; ( 3) 增大目标蛋白的可溶性,促进其正确折叠,提高蛋白表达量; ( 4) 便于重组蛋白的检测。目前,商品化的亲和标签已具备其中诸多特性,但性能更加优越、纯化效果更加显著的亲和标签仍需不断寻找与开发。
除 了亲和标签自身以外,降低纯化成本、简化纯化步骤、标签组合使用、同步去除标签、扩大纯化规模等,都是在使用亲和标签融合技术时需要不断改进与优化的方 面。近年来新出现了自剪切聚合标签、PHB 系统、ELP 系统等,逐渐在重组蛋白纯化过程中免去了层析步骤,使得所表达的重组蛋白能够自我纯化,省去了层析树脂的昂贵成本,简化了纯化操作,在简单的物理或化学处 理中,同时实现蛋白纯化与标签移除的双重目的,直接获得较高纯度的无标签目标蛋白。这些新颖的纯化标签系统为重组蛋白的有效纯化提供了更多的选择,在今后 蛋白质结构与功能的研究及重组蛋白纯化工艺的开发中应该得到更加广泛的应用。







