4月20日,Nature杂志在线发表了3篇CRISPR相关的研究进展。在题为“Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage”的研究中,科学家们报告称,一种经改造的CRISPR基因编辑系统能够赋予研究者们有效改变给定基因中单个DNA碱基的能力。这一研究进展进一步开拓了基因编辑的应用范围,且有望为开发多种疾病的治疗方法带来新的可能。
近几年,CRISPR–Cas9基因编辑系统被全球科学家们广泛应用,然而尽管很容易用它改变基因的功能,但是修复点突变一直是个未解的难题。该研究的通讯作者、哈佛大学化学生物学家David Liu说:“这些点突变非常重要,事实证明,大多数与遗传变异相关的疾病都是点突变。现有的遗传方法对修复点突变都不是非常有效。”
如何实现只“剪”一个碱基
Cas9酶的作用机制是在导向RNA分子的引导下靶向基因组中的特定位点。一旦Cas9酶发现与导向RNA匹配的DNA序列,它会切断DNA双链。细胞对此的反应是修复“缺口”,插入或删除碱基;但这一修复过程往往非常“草率”,最终的结果通常是产生一个“残疾”的基因。研究人员鼓励的一种修复模式是,通过提供一个能让细胞用作指导的DNA模板,从而使修复酶能够在缺口处插入匹配的DNA序列。但这种方法成功的时间不到5%,甚至更少。
在这一研究中,科学家们找到一种不用切割就能编辑基因组的方法。他们改造了Cas9酶,使它不再能够切割DNA;然后将其与另一种能够将一种碱基(胞嘧啶,C)转变为另一种碱基(尿嘧啶,U)的酶绑定在一起。U通常存在于RNA中,在DNA中细胞会把它当作T来阅读。在这样一个系统中,导向RNA将经改造的Cas9送到基因组中的目标位置,系统中的另一种酶(碱基修饰酶APOBEC1)发挥改变DNA序列的作用,而不是去切断它们。
结果发现,经改造的这一系统在试管中对单独DNA的作用约达44%的时间,这是一个很大的提高;但在细胞中,最好的效率也只有7.7%。一个问题是,这一系统只是改变了其中一条DNA链,会使其与另一条链不匹配。此时,细胞会开始修复这种“错误匹配”,抵消酶系统的作用。
随后,Liu的团队开始添加另一种蛋白到经改造的Cas9上,用于阻止细胞从DNA上去除U。最终产生的这一碱基编辑器(base editor)纠正了小鼠细胞中阿尔茨海默病相关的突变,有效率高达75%。同时,这一碱基编辑器还纠正了人类细胞中癌症相关基因的突变,效率高达7.6%。此前,标准的CRISPR-Cas9方法从未做到这样。
Liu说,还有成百上千的其它疾病相关的突变可能通过“C to U”开关纠正。不过,团队目前正努力将这种方法扩展到其它点突变,并尝试在动物模型中使用这一技术。他希望,这一系统能够使创建携带人疾病相关基因突变的小鼠模型更容易,最终,在经过多年的测试和改进后,能够用于疾病治疗。
张锋等科学家Cell发表CRISPR-Cpf1新成果
如今,在CRISPR系统中,Cas9酶已经不是唯一。去年9月25日,发表在Cell杂志上的一项研究中,张锋团队发现一种叫做Cpf1的蛋白可能将克服CRISPR-Cas9系统应用中的一些限制。科学家们评估了来自16种不同细菌的Cpf1酶,最终发现有2种Cpf1能够剪切人类DNA。Nature杂志表示,Liu等人的结果也许也可以用于CRISPR系统家族中的其它酶。
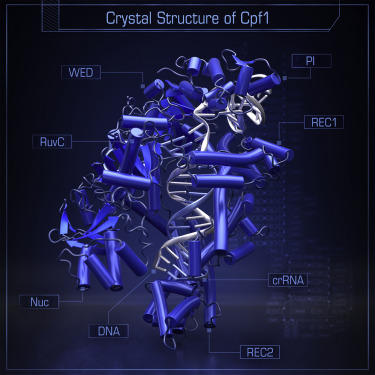
4月21日,发表在《细胞》杂志上的题为“Crystal Structure of Cpf1 in Complex with Guide RNA and Target DNA”的研究中,来自Broad研究所和东京大学的研究人员揭示出了Cpf1/向导RNA/靶DNA复合物的晶体结构。张锋及东京大学的Osamu Nureki教授是这一研究的共同通讯作者。
该研究中,科学家们确定了氨基酸球菌属(Acidaminococcus sp)Cpf1(AsCpf1)与向导RNA和靶DNA复合物的晶体结构,分辨率达到2.8 埃(Å)。AsCpf1采用了一种二裂片(bilobed)结构,RNA-DNA异源双链核酸分子束缚在中间通道内。他们通过比较AsCpf1和Cas9的结构,揭示出一些惊人的相似性和主要的差异,由此解释了它们独特的功能。AsCpf1包含RuvC结构域和一个推定的新核酸酶结构域,它们分别负责切割非靶向及靶向DNA链,由此生成交错的DNA双链断裂。AsCpf1借助了一些碱基和形状读取机制来识别5′-TTTN-3′PAM。
中国科学家破译CRISPR-Cpf1运行机制

黄志伟教授和课题组成员在实验室(图片来源:哈尔滨工业大学官网)
与Liu等科学家的研究结果同期发表的另外两篇Nature也与这一有望代替Cas9的Cpf1酶有关。在题为“The crystal structure of Cpf1 in complex with CRISPR RNA”的研究中,哈尔滨工业大学生命学院黄志伟教授及其团队首次揭示了CRISPR-Cpf1识别crRNA的复合物结构。
研究通过结构生物学和生化研究手段揭示了CRISPR-Cpf1识别CRISPR RNA以及Cpf1剪切pre-crRNA成熟的分子机制,这对认识细菌如何通过CRISPR系统抵抗病毒入侵的分子机理具有十分重要的科学意义。研究还发现,Cpf1并不是此前人们推测的二聚体状态,它本身是一个呈三角形的单体,位于该结构中间是一个带有正电荷的凹槽。这些研究为成功改造Cpf1系统,使之成为特异的、高效的全新基因编辑系统提供了结构基础。
据介绍,Cpf1和Cas9很大的不同在于:Cpf1仅需要一个拷贝的crRNA,而Cas9需要序列更长的tracrRNA和crRNA去识别、剪切底物DNA,较短的crRNA在转染细胞过程中将更高效。
该研究发现Cpf1在没有crRNA结合的状态下处于松散的构象,crRNA的结合引起Cpf1发生显著的构象变化。与Cas9结合sgRNA极为不同的是,仅仅crRNA的重复序列部分(repeat sequence)就能引起Cpf1构象的巨大变化,这反映了这类短小的crRNA与Cas9结合的长sgRNA的识别机制的巨大差别。该结构显示来自于H843、 K852以及K869催化残基侧链上的氮原子位于一个平面上,同时和RNA A(+20)的磷酸基团形成氢键,该结构证据表明Cpf1剪切pre-crRNA成为crRNA是一个碱催化的反应。
CRISPR先驱Emmanuelle Charpentier新成果
在题为“The CRISPR-associated DNA-cleaving enzyme Cpf1 also processes precursor CRISPR RNA”的研究中,CRISPR“两大女神”之一的Emmanuelle Charpentier领导的科学家小组证明了Cpf1在定向基因编辑中能执行RNA加工和DNA切割两个活动,这可能打开了对特定序列基因组编辑和沉默的新方向。
备注:本文部分内容编译自Nature,部分内容参考自生物通、黑龙江日报、哈尔滨工业大学官网、中国科学报。
推荐阅读
Gene-editing hack yields pinpoint precision







