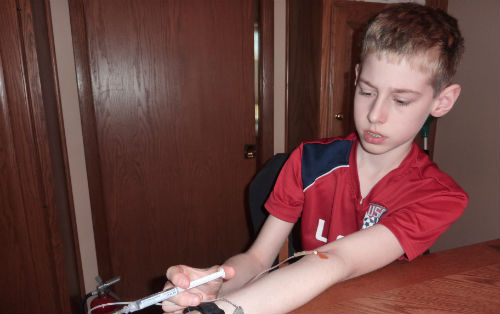
Ben Haugstad
Ben Haugstad是一个十二岁的小男孩,热爱跆拳道,已经练习了六年,马上就能成为跆拳道黑带了。你无法想象的是,他竟患有严重的血友病,他的身体无法生成凝血机制,也就是说,一次意外的摔倒或是擦伤都可能迅速演变成生命危机。
他的妈妈Kimberly每三周会起早为Ben注射帮助他在短时间内凝血的药物。“我从没想过要做一个护士”,她说。
这些注射剂十分昂贵,大约2500美元一剂,但它们是救命药。它们可以防止伤口恶化成一场灾难,以及确保自发性的内出血不会渗进关节或是器官里引发严重问题。目前,Ben过着一个基本正常的生活,他学习跆拳道,和常人一样参加体育课程。Kimberly表示,关于他身体状况的隐私,他从未谈及或是利用它作为逃课缺考的借口。每次课程结束,他浑身上下都会有一些关节受伤。
Haugstad说:“他想做自己可以做的,我们正在进行一个保持六周不流血的测试,这让我十分兴奋。”
值得一提的好消息是在未来的某个时候,Ben三周一次的注射可能成为历史。通过基因治疗,一个改进后的携带着特定基因指令的病毒会被灌输进Ben的身体,这可以给予他几年,甚至一辈子自行凝血的能力。
你可能会想,如果他的妈妈是一个大意的护士,面对这样的疗法一定会欣然接受,但事实上Kimberly对此的回应十分谨慎。
她说:“在他刚出生的时候,我们就听的非常清楚说血友病将在三年内研究出疗法,”她当时就明确地持怀疑态度,因为她还是美国血友病联盟的行政主管。某种程度上而言,她代表着许多父母,而不仅仅是她自己。
事实上,Kimberly有很好的理由对这种基因疗法保持谨慎。基因治疗血友病的想法始于20世纪80年代。大约15年前,第一个血友病患者志愿参加了测试。至今为止,还没有基因治疗的产品能够投入市场。
基因实验的临床失败和备受瞩目的安全灾难使得人们对基因疗法的态度发生了180度大转变,从之前的大肆宣传沦落至无人问津的境地。在21世纪初,很多重要的私人投资商都撤出了投资。虽然现在又重新复活,但在Ben或者其他任何400000名血友病患者可以指望基因治疗之前,仍有很多问题待解决——这些治疗会持续多久?它们的安全性怎么样?
基因治疗确实回归了。初创公司又开始重组了,并且有一些已经面向公众了。大的制药公司正在通过企业合作和战略联盟进行研发。有一个西方国家的首例针对罕见的肝脏损伤疾病的产品已在欧洲被通过;另一个可能用于治疗严重的血液疾病——地中海贫血。
基因治疗血友病已经远远地落后了,至今为止只有一个开发商,Baxter International (NYSE: BAX),进行临床数据报告。
在Baxter之后有几个公司——正确地看到了问题——他们今年和明年的临床进步将成为整个基因治疗的试金石。血友病在这场基因治疗争霸赛中可能会成为最具竞争性的一个。
“基因治疗的历史会跟随血友病的故事前行,”James Wilson,宾夕法尼亚大学的基因治疗主任,该领域的先锋,同时也是最受争议的人物。
根据目前为即将开始的临床试验而扭打成一片的公司现状判断,故事将开启新的篇章。有七个团队开始了血友病项目。他们是由保护盈利权益的大公司和正在或期待和大公司合作的小生物公司组成的一个大熔炉。此外,还有一些科学方法和战略,以及激烈竞争中出现的搅乱战术。
华盛顿基因治疗创始公司的科学创始人Wilson说:“我认为竞争是好的,你知道谁是最大的受益人吗?病人。”
如果这种局面真的发生了,就意味着好的结果将过很长一段时间发生——即使当今的病人状况已经比上一代或上两代要好的多。直到20世纪80年代,流血的血友病患者还需要赶到医院注射浓缩的凝血因子或者蛋白质:A型血友病患者注射VIII因子,B型注射IX因子。
如果流血严重的话可能要在医院带上几个星期甚至几个月,并且需要特别小心。更糟糕的是,注射的因子来自捐献者的血样,有时候可能会给血友病患者带来艾滋病或者丙型肝炎。
1982年,科学家们基因克隆了IX因子,实现第一次突破,VII因子则是在两年之后。第一个VII因子重组产品来自Baxter,1992年被FDA批准,这些药物完全改变了血友病的治疗。不仅结束了血液受污染的风险,还为预防性的治疗铺路。
“现在你拥有不记得自己曾血流不止的青年了,”Katherine High说,Spark治疗公司的主席和首席科学官,费城儿童医院的细胞分子治疗中心的主任,一个世界知名的血液学家。
粗略估计英国有20000名血友病人,3000名患有B型血友病,它是一种慢性的可控制的疾病,虽然仍然花费很高且难治愈。
根据国家血友病基金会报告显示,大约60%的血友病人口患有严重的疾病。他们的血液中仅有低于百分之一的必要凝血因子,所以他们会流更多的血,需要两到三周注射一次。如果出血比较温和的相对接受治疗的需要频率也比较低。
有一小部分公司正在研究蛋白质的替代药物,只需一周使用一次或更短周期的药物,或是帮助那些自身免疫系统不允许他们接受现有治疗的病人。Alnylam Pharmaceuticals正在研发一种使用周期更短的RNA干预药物。
完成了那些改进,基因治疗还在寻找药效持久的解决办法,甚至“一针搞定”的疗法。当然,不仅仅是血友病,这是众多基因疗法的目标。但事实上,30年前,血友病就曾尝试过使用基因治疗,当时技术不够发达,要说去实施治疗仍然有很多年要走。
很长一段时间里,基因疗法听起来就像是一本科学小说。你会觉得它是基因工程里危险的微型病毒,一种小型的运输工具或是带菌载体。然后那些工具被特定的基因指令包装:到达特定的位置,生成特定的蛋白质。甚至进入到干细胞去改变它的DNA,然后在这之后出现的每个子细胞都带有这些基因指令。
这个承诺是巨大的——找到一种在基因方面你了解的病症,一种由单个错误或基因缺失造成的病,并且编译一个能长时间持续的解决办法。在20世纪90年代,大批的始创公司涌现出来,但他们不久就面临了技术挑战,特别是关于病毒运载工具的问题。
“要比较出哪个带菌系统更容易应用,更易制作,或是更安全是要花费相当的时间的,”Barrie Carter说,拜玛林制药基因疗法监管的副主席。
对于血友病而言也是同样的,通常基因治疗的理想目标因为很多原因都会以该疾病为靶点。它是单基因的(由单个突变引发)。它是隐性的(为了治疗它,需要添加一个基因,而不是将他们都击倒)。而且只能修复一小部分表征——5%的正常人的VII和XI因子含量会发生显著的变化。
所有的效果都可以通过一个简单的血液测试来衡量。囊性纤维化和血友病是第一批参与基因治疗的疾病。 一切听起来是那么的理想,但事实上,基因疗法面临着巨大的压力。因为早在1999年科学家就写道,“如果基因治疗在血友病模型中不起作用,那么究竟在什么样的疾病模型中它才能起作用呢?”
90年代末,第一波血友病基因疗法试验开始。High领导一个小组参与;她与Alameda合作,Avigen的总部基因疗法启动。
High和她的同事没有专注于任何特定的技术。 关于病毒载体,“我尝试了一切,”High说,包括逆转录病毒和腺病毒,由于安全和其他问题现在已经被废除的病毒载体。
威尔逊认为,逆转录病毒对血友病是没用的。 它不会进入肝脏这个人体的凝血因子生产工厂。 而腺病毒,虽然熟练于找到目标肝细胞并表达基因,但不会产生持久的影响。 更糟糕的是,它可能有产生免疫反应的潜在危险。
这中危险在1999年成为了现实,一名18岁名叫Jesse Gelsinger的亚利桑那州少年在威尔逊的合作实验中病逝。Gelsinger患有一种罕见的基因遗传肝病称为鸟氨酸氨甲酰基转移酶缺乏症,通常患者为婴儿,但他并没有发病, 他通过严格的饮食控制和一些药物稳住了病情。 试验是测试基因治疗是否具有最终用于患者儿童的安全性。1999年的纽约时报写道, Gelsinger当时志愿参加实验的时候知道他可能无法受益于此, 但是结果他付出了更惨痛的代价。 通过腺病毒运输的基因治疗引发了免疫系统的攻击。 他患上了黄疸病,身体里出现了巨大的血凝块,器官开始衰退,四天后,他死于治疗。
威尔逊迅速被卷入了公众和法律漩涡的中心。 FDA暂停了实验并对其展开了调查,之后还波及了整个宾夕法尼亚大学的基因治疗研究。 威尔逊已经深陷诉讼,不久便爆出了研究的数据问题,研究人员没有报道实验最初一些猴子死于基因疗的事实。Genovo是宾夕法尼亚大学生物技术基因疗法(但不是Gelsinger的那个研究)的最大投资商,也因为威尔逊的关系惹上了麻烦。 威尔逊在1992年成立了Genovo,他和宾夕法尼亚大学都握有公司的股权。
“我当时遭受着猛烈的批评和攻击”威尔逊说。 (许多年之后,威尔逊会在《分子遗传学和新陈代谢》上写了一篇社论,叙述他的错误,以及从中获得的经验教训)。
这次重创也让基因疗法得到了教训,这一领域的公司都开始进入“控制伤害”模式。Carter记得他的前雇主发过一份新闻稿只为提醒人们他们不使用腺病毒。但糟糕的是:投资者变得轻佻,互联网泡沫破灭,大量的基因疗法初创公司崩溃。四个患有罕见的免疫疾病的孩子在一个法国基因疗法的研究中最初被治愈,而后病变成了白血病,其中一人于2003年死亡,该事件给予了基因治疗最后沉重的一击。
然而漩涡淹没了基因治疗取得重要进展的事实。 “腺相关病毒”也称 AAV,成为了一个基因治疗的常用载体。
威尔逊说:“AAV是游戏的转折点。”这个名字本身就是一个用词不当,AAV与腺病毒无关;它的名字是因为1960年代科学家们在腺病毒实验室准备工作中发现了它。它比腺病毒要小,并且没有参与过任何已知的疾病实验。 科学家在1984年首次制作了AAV载体;1994年,AAV的第一次应用于囊性纤维化病临床试验(由Targeted Genetics进行)。 五年后,第一个血友病试验进行(由Avigen和High组合进行)。
虽然所有的基因治疗营利性活动在泡沫崩溃和实验死亡出现后停止了,但是High,威尔逊,还有那些在该领域坚持下来的人们,不停推进着基因治疗进步,促使现在血友病竞争的局面得以出现。
威尔逊走了一条非常奇怪的路。在Gelsinger事件发生以后,他重组了公司而且并没有争取NIH的募款。他去找了一位老前辈——Tachi Yamada, SmithKline-Beecham(现在额葛兰素史克)的首席科学官,。
威尔逊只是希望去做一些咨询,但事实上他得到的更多。 Tachi说“我相信你。 我认为你能做到。 所以你需要多少钱? ”Wilson回忆说:“当时我很讶异,问他是什么意思, 他说SmithKline-Beecham 愿意资助你在这块领域的努力。”
威尔逊提出了300万到400万美元一年资助要求,山田一个电话就帮他搞定了。 没有复杂的申请程序,没有竞争,也没有焦虑。 威尔逊在接下来的几年里从英国大制药公司总共获得约4000万美元,在地下隐秘地工作。他有意避开科学讲座,不参加颁奖宴会,远离各种媒体。他说:“这所有的一切只为科学。”
High也深受这场灾难的折磨。 在Avigen血友病的研究中,一个接受AAV基因疗法的病人在持续产生IX因子四周后停止了,并且他的肝脏酶开始飙升,可能意味着炎症或损伤肝脏。 在一个post-Gelsinger的世界里,对于基因治疗技术有太多的未知,这是很吓人的。 更糟糕的是High没有看过基因治疗在动物实验中结果,她陷入了茫然。她说:“我们不知道发生了什么,我依稀记得那是我职业生涯中最具挑战性的时期之一。无人问津,没有动物数据可以求助。”
病人在澳大利亚接受治疗。 High只能无助等待每周两次的报告。但是慢慢地,让她欣慰的事发生了,病人的肝功能开始正常化,他不会再有生命危险。 然而Gelsinger案件后,FDA一直保持High度警惕,对实验喊停。 当实验恢复的时候,相似案例又再次发生在另一个病人身上。
两个案例都不是致命的,但Avigen已经受够了,决定完全撤出基因疗法。
这是一个大问题:Avigen正在为High制作载体。 所以她去找了CHOP的首席执行官Steven Altschuler,恳求设立医院,室内临床分级制造工厂。 这个决定并不容易,Gelsinger案件还在在诉讼中,外界对待基因治疗的态度十分消极。 但High坚信这些问题可以得到解决。 “我知道问题没有严重到不可收拾的地步”她告诉Altschuler: “我一直有个信念,如果你可以移植器官,那么你就可以移植基因。”
考虑了几天后,Altschuler决定支持High,但有一个条件:她必须在其他遗传疾病同时开展实验,不只是血友病。 CHOP不仅建立了制造业,它建立了一个完整的基因治疗中心。
“有时候,我觉得我的职业生涯就是在沿着一个问题列表走,用我的方式走到最后,然后开始一遍又一遍的完善,”High笑着说。
有了SmithKline-Beecham的资金后,威尔逊的团队重新聚集在一起寻找更好的AAV载体。 “我们成了病毒猎手,”他说,把AVV和任何我们可得到的资源隔离开来,猴子,猩猩,人,筛选他们的差异。
他们发现大约150个变异,它们将被命名为 AAV7,8,9……然后将他们转化为载体。
威尔逊实验室这一连串的载体工作也是血友病故事的一部分。 威尔逊的博士后团队之一王丽丽,一直在研究用AAV2治疗狗狗的B型血友病,但它产生的IX因子含量太低。于是王丽丽又尝试了一个新的载体——AAV8,在同一只狗身上,结果因子含量翻了20倍。
AAV8 不像AAV2一样在人体普遍存在;也许不会触发免疫系统的警报。2005年,小王和威尔期刊《Blood》上共同发表了的一篇论文来分享这个结果。
在此期间,威尔逊不断鼓励学者使用这些载体来做他们自己的研究。 High就是其中之一。
Carter说《新英格兰医学杂志》证明基因疗法能通过简单的外围静脉注入让病人达到临床需要的IX因子含量。 米尔斯记得他接到过些许电话,是从从投资者和大型制药公司打来的,试图找到数据和技术的来源。“这是一个巨大的转折点,”米尔斯说。
事实上,AAV专利的争夺战已经打响。 下面是所有参与者找到的自己的市场定位:
——Baxter使用AAV8治疗血友病,它通过购买查塔姆疗法获得的专利 。 查塔姆是从葛兰素史克/ RegenX获得的 AAV8许可。
——UniQure使用AAV5治疗血友病,它是在2011年9月由国家卫生研究院授权。 在2010年,它获得了圣裘德/伦敦大学学院基因治疗项目的权利。
——Spark在内部制造属于它自己的 AAV载体,且未公开细节。它正在与辉瑞合作治疗B型血友病。
——Dimension在 2013年10月由富达生物科学和RegenX 成立;享有使用RegenX AAV载体的许可证,同时正在和拜耳公司合作基因治疗A型血友病。
——BioMarin 在2013年2月从圣裘德/伦敦大学学院获得A型血友病的项目许可证。
这些团体之间的差别是非常技术性的。 以载体为例。UniQure使用的AAV5,他的首席营销官Meyer认为它应该留在体内很长一段时间制造蛋白质,因为它不太可能像AAV8一样引发免疫反应。
然后还有基因上的差别。 一些公司,比如Baster和Spark,使用的是突变后的治疗基因,凝血能力比正常细胞强8到12倍。 最初的版本从一个年轻的意大利帕多瓦人身上发现的。 好处是患者只需使用小剂量就可以达到想要的疗效。
其他像UniQure、BioMarin和Dimension,使用的是产生正常的凝血因子量的基因。优势是结果应该更容易预测。
一个潜在的限制是AAV对年幼的儿童来说可能不会持续太久。因为他们的肝脏在生长,AAV修饰细胞会被洗出去。 这也是分别使用 lentiviral载体和基因编辑方法的两家公司的主要争议点,通过一个协议 与夏尔 )的疾病。 这两种方法的目标都是创建永久修复的疗法。 相比之下,AAV只要细胞活着它就可以持续工作。
“我们认为AAV载体无法提供持续释放的量,”Sangamo的首席科学官菲利普•格雷戈里说。 “我们可以使它保持长时间工作,针对最需要的新生儿和小孩子。”Haugstad非常重视这个问题。 她担心严重的血友病患儿要带着针头的生活。
“也许小吉米10岁的时候打一针可以安全地过4年,现在他14岁,是个完全活跃的正常青年,但是突然他的血友病又复发了,到底发生了什么? 我们要怎么处理对整个家庭造成的心理阴影?”
它表明,尽管已经取得了进展,基因治疗要越过它最大的敌人仍然有很长一段路要走。这也让威尔逊在他60岁生日即将到来之际开始了深思。
“我告诉我的妻子,我的职业生涯是将在60岁开始。 基因治疗现在才是真正的诞生。 这是开始,不是结束,”威尔逊说。 他的妻子反问道:“那么,35年来你一直做什么呢?’”
他的回答是:“把它弄明白!”
推荐阅读:
Stop the Bleeding: Can Gene Therapy Finally Cure Hemophilia?