
近日,发表在《美国化学会传染病》(ACS Infect. Dis.)杂志上的一项研究中,美国布朗大学化学系(Department of Chemistry, Brown University)Jason K. Sello等人研究发现,通过对抗菌药物分子的改造,特别是分子诱导,能够延长药物在微生物细胞内的滞留时间(见图1),从而提高抗菌药物的效力,为药物设计提供了新思路。

图1 母体化合物与衍生物在细胞内的滞留比较
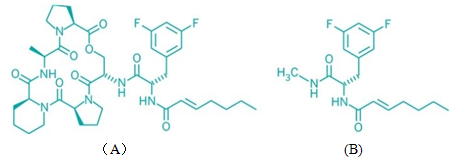
图2 母体化合物及其衍生物的结构式
图2B是环酰基缩酚酸酞(cyclic acyldepsipeptide),图2A的一种衍生物,可以促进母体药物的效力。
细菌有时为了保护自己免受有毒分子的伤害,会通过活化其细胞质将有毒分子从其中驱逐出去。这种防御通常靠抗生素激活,使细菌对药物产生耐药性。在这项研究中,研究人员用一种片段分子来补充一种药物分子,从而达到抑制其流出细胞之目的,为设计耐药细菌治疗药物提供一种新途径。片段分子的作用就像是分子诱饵,阻止较大药物分子的传输。
细菌耐药性机理有多种,影响主动流出系统(active efflux system)就是其中之一。某些细菌能将进入菌体的药物泵出体外,泵出的过程因需能量,故称其为主动流出系统。由于这种主动流出系统的存在及其对抗菌药物具有选择性的特点,使大肠埃希菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、铜绿假单胞菌(Pseudomonas aeruginosa)、空肠弯曲杆菌(Campylobacter jejuni)对四环素、氟喹诺酮类、大环内酯类、氯霉素、β-内酰胺类产生多重耐药。
细菌的流出系统由蛋白质组成,主要为膜蛋白。这些蛋白质来源于以下4个家族:①ABC家族(ATP结合盒式转运体类,ATP-binding cassettes transporters),②MF家族(主要易化超家族,major facilitator superfamily),③RND家族(耐受-生节-分裂家族,resistance-nodulation-division family),④SMR家族(葡萄球菌多药耐药家族,staphylococcal mulitdrug resistance family)。流出系统有3个蛋白组成,即转运子(efflux transporter)、附加蛋白(accessory protein)和外膜蛋白(outer membrane protein),三者缺一不可,故又称三联外排系统。外膜蛋白类似于通道蛋白,位于外膜(G-菌)或细胞壁(G+菌),是药物被泵出细胞的外膜通道。附加蛋白位于转运子与外膜蛋白之间,起桥梁作用;而转运子位于胞浆膜,它起着泵的作用。
斯图亚特•莱维(Stuart B. Levy)博士在20世纪90年代初就已经证明了细菌通过形成主动外排系统对抗生素产生耐药性,四环素类抗生素的主要耐药机制就属于此类。[原文文献]
抗生素激活外排泵系统后,药物的外排功能可显著增强,并对多种抗生素产生作用,显现为多重耐药。此过程为主动耗能过程,其能量来源于质子移动力或ATP,并表现出能量依赖性;底物的广泛性是此外排泵系统的另一特点,它表现为对各种抗生素、化学合成抗菌药、金属离子、消毒防腐剂、去污剂、抗菌染料和表面活性剂等的外排作用。
主动外排泵系统是细菌形成多重耐药性的生物学基础。与细菌多种抗生素耐药性有关的主动外排泵系统主要有5个家族类:即ATP结合盒转运体(ATP-bindingcas-settes transporters)类、药物与代谢物转运体超家族(drug/metabolite transporter superfamily)类、多重药物与毒物外排家族(multidrug and toxic compound extrusion family)类、主要易化因子家族(major facilitator superfamily)类以及耐受-生节-分裂家族(resistance-nodulation-division family)类。药物外排系统在不同菌属有不同基因编码,如肺炎链球菌为pmrA基因,而金黄色葡萄球菌为norA基因。但这些外排系统如何被激活和调控其机理目前尚不清楚。
但是,几乎所有种类的抗菌药物都是细菌外排泵系统的目标。科学家认为,蛋白质分子有其选择特定分子的结合位点即小区域,一旦结合,蛋白质分子会将药物分子泵出细胞之外。布朗大学的詹森•塞洛(Jason K. Sello)和他的同事们测试是否一种大分子药物的片段,可与这些泵相结合来限制将药物分子整体排出。研究人员以环状的酰基缩酚酸肽类物质(acyldepsipeptides简称ADEPs)作为研究对象;这类物质是属于抗生素类药物,其目标就是如结核分枝杆菌(Mycobacterium tuberculosis)的微生物。
詹森•塞洛及其同事合成了4种片段,每一种都含一些ADEP侧链,这种分子的结构可能是阻塞药物排出最有效的结构。研究者将每种片段和母体ADEP一起用于不同细菌菌株,然后确定哪一对抑制微生物的生长效果最佳。结果发现,获胜的片段包括具有一个庚烯基(heptenoyl group)的含氟芳香族氨基酸(见图2A)。
为了更进一步增强其片段的效力,研究小组还对其进行了一些小的化学改变。当将其用于实验室培养的对ADEP有耐药性的结核分枝杆菌(M. tuberculosis)时,优化片段使ADEP对微生物生长抑制效果,是单独使用抗生素的2.5~5倍。
测试结果表明,药物开发者可以用某些药物片段与抗生素混合在一起,使抗生素药物获得某些形式的阻力,以便在细菌细胞内滞留而不被排出。但这一策略需要进一步探索,包括通过动物模型进行相关试验等。詹森•塞洛认为还需要测试这种方法对于其他抗生素而言是否具有兼容性或者说是同样有效。另外,这种方法是否适用于如红霉素(erythromycin)一样结构上更复杂的化合物还需进一步研究。
贝勒大学医学院(Baylor College of Medicine)的达米安•杨( Damian W. Young) 认为,这项研究是对一个非常具有挑战性的问题而提出的创新研究方法。他说:“对抗耐药细菌需要两种方法,一是开发新药物和使现有药物焕发新生机、使其更加有效;二是想办法增加现有药物的有效性,让其在细菌内滞留足够长的时间,这也就是这项研究所做的工作。如果此方法可以应用于其他类型的抗生素,它将对开发新疗法提供了一种急需的新策略。”







