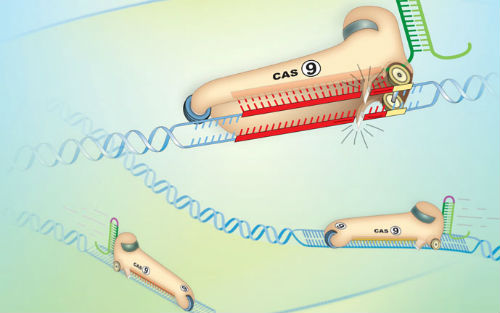
模型在人类遗传疾病的潜在机制研究中有着极其重要的价值。然而在胚胎干细胞中采用传统的转基因或基因打靶技术来构建动物模型这一过程相当耗时费力,因此限制了人们当前对于一些遗传疾病的认识。由于导向RNA(gRNA) 设计颇为简便,且较易将它们传送到单细胞胚胎中,CRISPR/Cas系统彻底改变了构建基因靶向敲除和敲入动物模型的方式。
在缺乏供体模板如单链寡脱核苷酸(ssODNs)的情况下,共同导入Cas9 mRNA和gRNAs可通过容易出错的非同源末端连接(NHEJ)信号通路将一些突变导入到靶基因位点;在存在供体模板的情况下,借助同源重组(HR)的同源介导修复(Homology-directed repair, HDR)则占据主导地位,可由此获得无误差DNA修复。CRISPR/Cas系统的另一个显著优点就是能够实现多重基因编辑。这一特点尤其有助于剖析由多个遗传变异促成的疾病表型,例如癌症。近期的一项研究就报道称,采用CRISPR/Cas系统同时介导了肿瘤抑制基因Pten和p53的定向诱变,模拟出了传统的Cre-loxP方法删除Pten和p53的表型。
尽管具有这些潜力,由于Cas9转基因相对较大,由于通常使用的慢病毒和腺相关病毒(AAV)载体负荷能力有限,在体内实现多重基因编辑仍然是一个挑战。其中一种解决方法就是构建Cas9基因敲入动物,可由此避免传送Cas9这一需要,而为其他的目的DNA序列腾出一些空间。
虽然以核酸酶为基础的基因组编辑技术广泛流行,人们仍然对此抱有某些担心,包括在基因治疗中不希望出现的脱靶突变以及癌基因激活效应。而作者们在文章中指出,近来一些研究团体好消息频出,推动了以核酸酶为基础的基因治疗。例如在发表于《细胞干细胞》(Cell stem cell)杂志上的一些新研究论文中,三个研究小组报告称证实如CRISPR/Cas系统、辅助病毒依赖性腺病毒载体(HDAdVs)和TALEN等靶向基因编辑技术均只生成了低水平有害的脱靶突变。
此外,一些研究小组还成功利用CRISPR/Cas系统在成体干细胞中纠正了疾病相关的突变。例如中国科学院上海生命科学研究院生物化学与细胞生物学研究所李劲松研究组和吴立刚研究组以及北京大学汤富酬研究组在一项合作研究中,利用CRISPR-Cas9技术在小鼠的精原干细胞中修复了遗传缺陷,产生了完全健康的后代。在另一项研究中,麻省理工学院的研究人员证实了CRISPR基因编辑技术可以逆转活体动物的疾病症状,治愈了因单一遗传突变致罹患一种罕见肝病的小鼠。令人印象深刻的是,来自京都大学的研究人员描述了一种策略,靶向了三个不同的隐性突变,由此逆转了大鼠的一些疾病相关表型。
在文章的最后,作者们指出尽管在动物体内打靶研究中取得了这些进展,为研究和治疗人类遗传疾病带来了极大的希望,仍然存在一些障碍需要克服。第一是,需要改善CRISPR/Cas9系统元件的传送。第二是,进一步优化细胞类型特异性。第三是,目前大多数研究还是在小鼠中开展,小鼠和人类之间的一些物种差异可能会阻碍将从小鼠研究中获得的一些知识成功应用于人类治疗。