手性(Chirality)是自然界的本质属性之一。作为生命活动重要基础的生物大分子,如蛋白质、多糖、核酸和酶等,几乎全是手性的,这些分子在体内往往具有重要生理功能。另外就目前所用的药物而言,多为原子总数不足50个,但是这些有机小分子药物中很大一部分也具有手性,当然分子量更大一些的绝大多数的药物同样具有手性结构,1993年97种热销药物中手性药物仅占20%,五年之后的1998年全球最畅销的500种药物中,以单一异构体销售的手性药物占一半以上。20世纪90年代末,全世界单一手性对映体药物的销售额已经达到1150亿美元,而且进入21世纪之后,估计其销售额的年度增长量在8%左右。全球对单一对映体药物依然持续增长,1998年销售额已经达到990亿美元,1999年达到1150亿美元,2000年销售额为1330亿美元,2008年销售额在2000亿美元左右。
手性药物研究成为国际新药研究的主要方向之一
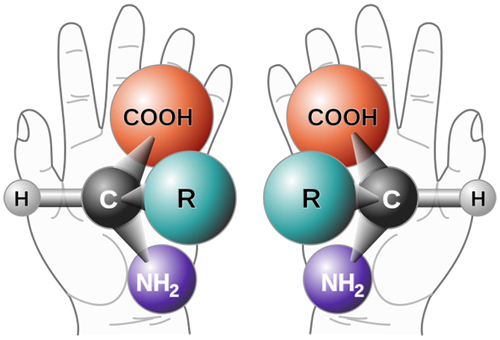
药物的药理作用是通过药物分子与体内大分子之间严格地手性匹配与分子识别来实现的。药物分子必须与受体分子几何结构匹配,才能起到应有的药效,犹如右手只能带右手套一样。
大量的事实已经证明,手性药物的研制和生产在临床上有着十分重要的作用。因为对映异构体之间的生物活性存在着差异;不同的对映体之间活性的差异是不同的;当手性药物的药效剂量越低,即药效强度越高时,则对映体之间的药理作用的差别越大。
从药理学的角度来说,服用单一对映体的手性药物可以减少用药剂量和代谢负担,以便对药物动力学及剂量进行更好地控制。在用药剂量设计时,使用单一对映体可以使剂量幅度更宽,因为副反应较小,减少了与其他药物的相互作用,提高活性并减少剂量,提高了专一性、并降低由某对映体可能引起的副作用。
从绿色生产的角度来看,单一对映体手性药物的生产,可以实现资源利用的最大化,将低效、无效甚至有害的对映体转化为有效成分加以利用,不仅可以节约资源、减少废物排放,又可以降低对环境造成的污染。
因此,已经有许多国家的药政部门对于手性药物的开发、专利申请以及注册,要求对对映体的应用效果提供必要的生理活性和毒理数据,开发单一对映体药物已经成为药品研发的未来必然趋势。因此,对于具有手性结构特征的对映体混合物分离,在制药行业就显得格外重要,因为不同的对映体药物分子可能有不同的生物效应,这就是为什么当前手性药物的研究已成为国际新药研究的主要方向之一的原因所在。
但是,需要注意的是,含手性因素的化学药物的对映体在人体内的药理活性、代谢过程及毒性存在显著差异,以尼古丁为例,天然的(-)- 尼古丁毒性比(+)-尼古丁大得多。再如氨氯地平(Amlodipine,化学名称 6-甲基-2-(2-氨基乙氧基)甲基-4-(2-氯苯基)-1,4-二氢-3,5-吡啶二甲酸甲乙酯 )的左旋体可以治疗高血压,而它的右旋体则没有这种功效。
有的含手性因素的药物对映体作用强度也不一样,如胃安(硫酸氨戊酰胺,aminopentamide sulfate)的抗胆碱作用,它的左旋体比右旋体的生物活性强四倍。还有S-(+)-前列腺素[S-(+) –prostaglandins]的活性是体外合成的其对映体活性的160倍。
最让人担心的是两种对映异构体中仅有一种是有效的,另一种不仅无效甚至有害的。在20世纪60年代初曾流行一时的孕妇服用的反应停对映体混合物,发现会对胎儿造成肢体先天性致残,可能是其中一种对映体有抑制孕妇晨吐的治疗作用,而另一种对映体则有可能对胚胎发育有害。
因此,在医疗医药的使用中,需要把握对映体对人体生理的影响,特别当使用工业合成的对映体混合物作为食品添加剂时,更加需要关注手性物质对人体生理的影响,以防对人体造成永久性致残损伤。
反应停事件-难忘的沉痛教训
人类发明的化学药物,既给人类带来了极大的益处,成为人类健康的保护神,但也给自己造成了意想不到的伤害,对化学药物的盲目依赖和滥服药物,已造成了许多不应有的悲剧。医药史上最让人难以忘怀的沉痛教训,就是发生在20世纪50年代末,60年代初的“反应停事件(Thalidomide Incident)”。
反应停(Thalidomide)1953年首先由西德一家制药公司(Chemie Grünenthal ,现在的 Grünenthal GmbH)合成,1954年4月获得20年的专利权,1956年11月进入临床试验,并在市场试销,1957年10月1日正式投放市场,商品名称为Contergan®。最开始时,研究人员发现这种药物对于早孕期间的孕吐反应有很好的止吐作用,并且对孕妇无明显毒副作用,反应停随即相继在50多个国家和地区获准销售,广泛应用。
但实际上,反应停能够有效地阻止女性怀孕早期的呕吐,也妨碍了孕妇对胎儿的血液供应,导致大量“海豹畸形婴儿(没有臂和腿,手和脚直接连在身体上,很像海豹的肢体,又称“海豹胎”)”出生。
1959年12月,西德儿科医生A. Weidenbach首先报告了一例女婴的罕见畸形。1961年10月,在原西德妇科学术会议上,有三名医生分别报告发现很多婴儿有类似的畸形。同年在德国、英国、澳大利亚等国先后出现了多例相关病例。
W. G. McBride和W. Lenz分别在1961年和1962年给《柳叶刀》的信中都明确指出反应停与先天性畸形有关(McBride, W. G.. Thalidomide and congenital abnormalities (letter). Lancet, 1961, 2: 1358. Lenz, W. Thalidomide and congenital abnormalities (letter). Lancet, 1962, 1: 45.)。除肢畸形外,还可引起其他畸形的发生,如十二指肠狭窄(duodenal stenosis)、食道瘘管(oesophageal fistulae)、神经管畸形(neural tube abnormalities)、微眼炎(microopthalmia)、耳廓畸形(deformities of the pinna of the ears)、中线血管瘤(mid-line haemangiomas)等。医学研究表明,"海豹胎"的病因,是妇女在怀孕初期(第35天至50天)服用反应停 (酞胺哌啶酮)所致。
从1956年反应停进入市场至1962年撤药,全世界50多个国家和地区(包括我国台湾省)共报告了“海豹胎”上万例,各个国家畸形儿的发生率与同期反应停的销售量呈正相关,如在西德就引起至少6000例畸胎,英国出生了5500例,日本约1000余例,我国台湾省也至少有69例畸胎出生。尽管美国官方采取了谨慎态度,没有引进这种药,但是,据有关起诉材料透露,美国至少也有2万名患者使用过反应停,究竟有多少孕妇使用并不清楚。
反应停所造成的胎儿畸形,成为20世纪最大的药物导致先天畸形的灾难性事件,至今仍有法律纠纷。后来研究表明,反应停是第一个被明确为人类致畸的药物(J. M. Gardner-Medwin,R. J. Powell. Thalidomide -the way forward. Postgrad Med J, 1994, 70, 860- 862.)。
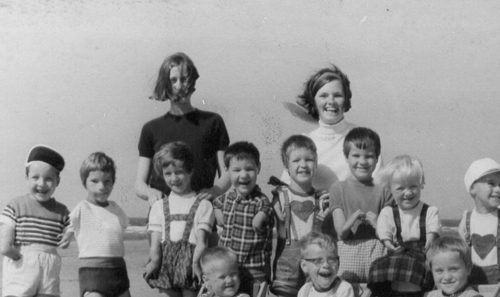
因反应停造成手脚畸形的孩子
反应停究竟是如何致畸的?通过对数十种不同种属动物进行的致畸试验表明,反应停对大约15个种属的动物有不同程度的致畸作用,并且致畸作用有明显的种属差异。小鼠和大鼠的大部分种系不敏感。家兔的几个种系和绝大部分灵长类动物较敏感,并可观察到与人相似的缺肢或短肢畸形。在敏感期给母猴一次剂量反应停,可使其胎儿100%发生海豹肢畸形儿。
有关研究表明,反应停对胚胎的毒性,有明显的时间性,即敏感期。在不同的孕期服用反应停,可引起不同的畸形。如停经后 34-38天(受孕第20-24天)服药,可引起无耳畸形与颅神经畸形;如停经后36-45天服药,可引起心脏与血管的畸形;而缺臂、短脚则是在停经后38-47天服药所致;但在停经50天后服药,一般不会引起畸形。
研究结果表明,反应停造成的胎儿畸形,主要不是药物的毒性,而是药物的强烈致畸作用。以前的研究证实,反应停是一种外消旋的混合物,其中致畸作用仅限于其组分中两种互为对映体的手性分子中的一种,另一种分子是安全的。但是新近研究结果发现,不仅反应停是外消旋的,就是单个对映异构体体也可以使外消旋的,是由于手性中心的酸性氢所致,而且此过程可能发生体内[76-79],所以就反应停而言,任何计划来拆分一种纯净的单一对映体,以避免产生畸形的影响很可能都是徒劳的[78-81]。
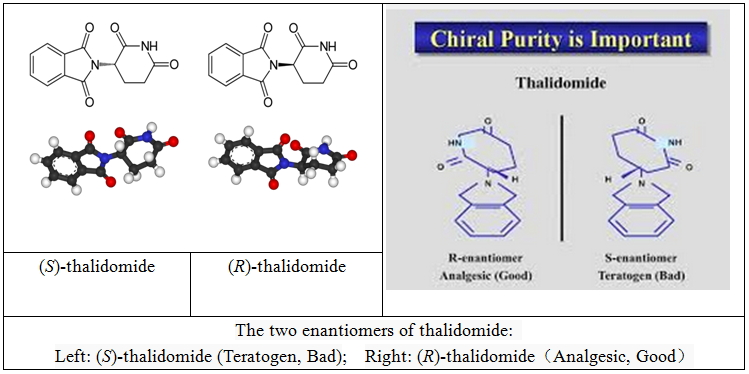
反应停分子对映体的两种不同的空间结构
反应停事件使人们对手性药物对映体分离重要性的认识更加深刻,但是,要把它们分离开来,是一项充满挑战性的工作。自从认识到化合物分子的这种空间结构的不同之后,科学家们一直在研究一种被称为“手性合成”的化学合成方法。就是通过使用具有特殊结构的原料或者选择具有特殊结构的催化剂(包括酶催化)来合成主要含有某种对映体的化合物,再通过特殊的分离方法,获得纯的单一对映体。因为不同的光学异构体往往具有不同的生物活性作用。所以,手性合成方法和对映体分离方法的研究对我们获得高效的药物具有重要意义。
对映体分离-新方法层出不穷
由于手性物质的不同对映体对生物体的生理活性不同,分离和合成出纯净的单一对映体就是人类梦寐以求的事业。但是大自然并没有给予我们现成的恩赐,只给我们人类一些提示——纯净的手性物质在大自然中含量有限,甚至极其稀有,人类知道了它们的用途,大量需要时,就不得不通过人工合成,而工业合成的是两种对映体1比1混合物,即是外消旋体,由于对映体之间理化性质的相近,要真正得到纯净的单一对映体,目前对我们人类来说还有不少的合成和分离上的难题需要解决。
如氨氯地平(amlodipine)是一种手性钙拮抗剂,目前市场上销售的用于治疗的就是外消旋混合物,其实就是一种对映体(R)-(+)- 氨氯地平和(S)-(-)-氨氯地平的1比1的混合物(见下图),斯洛文尼亚(Slovenia)和奥地利(Austria)的研究人员合作,已经研究出分离(R)-(+)-氨氯地平和(S)-(-)-氨氯地平的半制备色谱纯化方法。
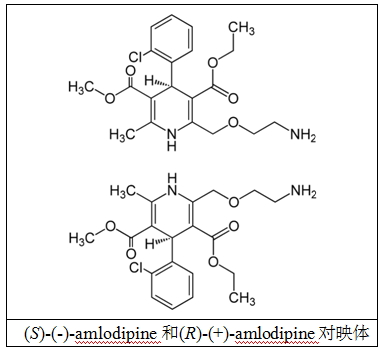
(S)-(-)-amlodipine和(R)-(+)-amlodipine对映体
关于对映体的拆分方法有多种:如结晶法(酒石酸铵钠外消旋混合物的分离,也可以认为是物理分离法)、膜法(Membranes)、酶法(Enzymatic Resolution)、液-液萃取法(Liquid-Liquid Extraction)、超临界流体色谱(supercritical fluid chromatography)法、化学法(是利用外消旋混合物与手性试剂反应后生成有不同性质的非対映体,从而利用生成物的不同物理性质如溶解度、蒸汽压、结晶速率等将其分离,再将分离后的物质分别还原成之前的对映体)、色谱分离法(Chromatographic Separation Methods,其中包括高效液相色谱(HPLC)法和气相色谱(GC)法)、毛细管电泳(Capillary Eelectrophoreisis)法、分子烙印法(molecular imprinting)、气相色谱-质谱法(Gas chromatography-mass spectrometry)、核磁共振法(nuclear magnetic resonance)、电色层分离法(electrochromatography)、传感器(Sensors)等,但是并非每一种方法对任何对映体都适用,需要根据不同的对映体选择适合的拆分方法,所以对映体的拆分已成为新药研究和分析化学领域的重要课题。巴西圣•弗朗西斯科大学(Universidade São Francisco)和圣•卡洛斯联邦大学(Universidade Federal de São Carlos)的研究人员合作,对于对映体的分离技术研究进展有专门论述,可以参考相关文献,了解相关研究。
据美国《化学与工程新闻》(C&EN)网站2014年1月13日报道,我国山东师范大学化工与材料科学学院分子和纳米探针教育部重点实验室唐波(Bo Tang)等研究人员已经成功地研制出一种可以用于手性化合物分析的金属-有机骨架化合物(Metal-Organic Framework,简称MOF),此化合物可以用于色谱柱,经过高效液相色谱法实现对映体药物的有效分离。
下图就是一个对映体分离器示意图。MOF是由锌(绿松石锥体)和手性配体salen构成,当对映体混合物(如左上角的绿色和紫色的分子)分子被吸附到MOF的孔穴时,MOF即可对其对映体混合物进行分离,此项研究成果已发表于《分析化学》 (Analytical Chemistry) 杂志上。
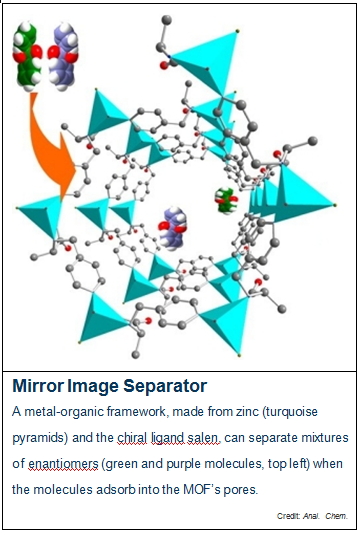
具体来说,MOFs是由金属原子和配体通过配位键而形成的三维易装结构。当化学家使用手性配体与金属中心原子形成配位键时,他们就可以产生一种具有手性孔穴的MOFs。因为单个对映体对于这些不对称孔穴具有不同的亲和力,唐波推测手性MOFs可以用来分离同分异构体的对映体。研究者使用锌和一种用吡啶功能化的手性配体(salen)合成了一种MOF化合物。然后将此化合物晶体填充到一个高效液相色谱柱当中,作为布洛芬(ibuprofen)、苯乙胺(phenylethylamine)和安息香(benzoin)对映体分离柱的固定相使用。
实验结果发现,此分离柱很容易使这三种对映体混合物分离,但是它并不能使酮洛芬(ketoprofen)和萘普生(naproxen)的对映体分离,因为这些分子的大小比MOF的孔穴的直径更大。
日本名古屋大学(Nagoya University)名誉教授冈本佳男(Yoshio Okamoto) ,同时也是我国哈尔滨工程大学(Harbin Engineering University )的特聘教授、云南师范大学客座教授,北京化工大学名誉教授,是开发多糖衍生物类手性固定相研究领域的权威人士,因为在手性分离材料的开发研究领域做出杰出贡献,冈本佳男曾经获得2006年诺贝尔化学奖的提名,他使多糖衍生物类固定相发展成为相当有用的对映体的分离工具。
冈本佳男对于唐波等人的研究成果评价认为,尽管使用MOFs来分离手性化合物是MOFs材料的一种新应用,但是,要想知道是否提供了优于目前手性分离普遍使用的多糖分离柱,尚需要更多的实验研究才能得出结论。
冈本佳男认为许多药物分子如酮洛芬(ketoprofen)和萘普生这样的对映体,其分子大小都大于MOF的孔隙(约9.8Å),是否会造成无法进行对映体的分离有待进一步观察。但是参与该项目研究的山东师范大学的马瑜(Yu MA)博士认为,MOF孔隙大小可以通过选用不同的金属原子和配体很容易进行调整,最终结果如何,让我们拭目以待吧。







