
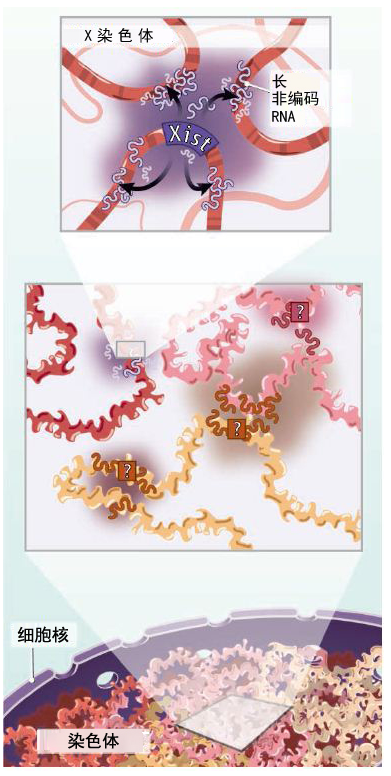
长久以来,RNA一直被我们看作是基因组的“信使”分子,他们携带着DNA里隐藏的编码信息,指导蛋白质的合成。不过在细胞内还存在大量的短非编码RNA(short noncoding RNA)和长非编码RNA(long noncoding RNA)分子,其中有很多RNA分子可能都具有非常重要的调控功能。虽然我们对长非编码RNA的作用机制并不熟悉,但是很多研究都发现,这些RNA分子可能起到了一个向导的作用,他们将各种调控蛋白质招募到一起,组成调控蛋白复合体(protein regulatory complexes),并且确保这些复合体结合到基因组中特定的位点上,发挥基因表达调控作用。不过这些RNA都与基因组中的哪些位点接触并结合,这还是一个未知数。Engreitz等人研究发现,小鼠基因组编码的一种长非编码RNA——X染色体失活特异转录本(X-inactive specific transcript, Xist)就能够特异性地与小鼠X染色体中的特定位点结合,它们中间的结合利用的是一种染色体三维拓扑结构。
Xist RNA在雌性动物细胞内能够起到剂量补偿作用(dosage compensation)。由于雌性哺乳动物拥有两条X染色体,所以使其中的一条染色体失活能够防止X染色体上的某些基因在雌性动物细胞内的表达量超过雄性动物的表达水平(雄性哺乳动物只含有1条X染色体)。所以在需要使X染色体失活时,细胞内就会合成17kb长的Xist RNA,而且该RNA就是由即将被抑制的X染色体编码的。然后Xist RNA会招募多梳蛋白抑制复合体2(polycomb repressive complex 2, PRC2),抑制细胞中1条X染色体的基因表达。最终,Xist RNA会将整个失活的X染色体包裹起来,形成一种在显微镜下看来好像“云”一样的结构,即所谓的沉默区间(silencing compartment)。少数并未被沉默的基因则会游离在沉默区间致密的核心结构区域之外。Engreitz等人开发了一种方法,可以寻找RNA在整个基因组中的结合位点,他们通过这种方法在基因组水平揭示了上述基因沉默现象。和在显微镜下观察到的情况一样,Engreitz等人也发现,在小鼠成纤维细胞里,Xist能够和整个X染色体上的多个位点结合,而“漏网的”未沉默基因和Xist接触的机会就要少得多。
不过科学家们最感兴趣的问题还是,在使X染色体失活的过程中,Xist RNA是如何以这种方式与X染色体结合的。为了研究这个问题,Engreitz等人使用了一种可诱导的系统(inducible system),以小鼠的胚胎干细胞为研究对象,人为地让细胞表达Xist RNA,然后在不同的时间点对Xist RNA与基因组的结合情况进行了连续的观察和研究。他们发现,Xist RNA在转录合成时并不是均匀地从X染色体中伸展出来,而是在从转录序列处合成之后就直接“跳到了”结合位点处。
那么Xist RNA是如何与这些远隔的基因组特定位点结合的呢?可能是因为他们之间有着比较高的亲和力,所以Xist RNA会与基因组中的这些高亲和力位点结合。不过Engreitz等人却没有发现基因组中有任何“异常”的特征,来解释这种Xist RNA在合成之后立即与特定位点结合的早期结合现象。于是Engreitz等人决定采用别人通过Hi-C技术(这是一种高通量的染色体构象捕获技术,几乎能够对细胞核内的每一个DNA序列进行分析)获得的数据,重建基因组的三维结构,看看是否能够找到一些突破口。结果发现,这些Xist RNA最开始结合的位点,在空间位置上都是和Xist RNA转录位点非常接近的。这说明Xist RNA可能是与空间位置比较接近(而非线性序列结构上比较接近)的序列相结合,从中找到特异性作用靶点的。于是Engreitz等人又进行了一个非常重要的实验,他们让X染色体上的另外一个位置表达Xist RNA,结果就发现Xist RNA最初的结合位点也随之发生了改变,变成了和这个新表达位点在空间结构上比较接近的位置,这也证实了Engreitz等人的猜测。
通过对这些早期结合位点的分析,Engreitz等人发现Xist RNA需要利用A-repeats元件搜索整个活性基因,并使之沉默。这种A-repeats元件也是Xist RNA招募PRC2复合体,并且使活性基因进入Xist沉默区间的必需结构。于是Engreitz等人提出了一个Xist沉默机制模型,X染色体利用自身的三维立体结构,使新生的Xist RNA与附近的早期结合位点结合,然后Xist RNA又会反过来影响、改变X染色体的组织结构,最终使X染色体沉默。
至于Xist RNA分子的二次移动(secondary spreading)问题,以及是通过何种机制保证Xist RNA分子不会任意扩展,对其它的基因、或者其它的染色体进行不必要的抑制,这方面还有很多问题值得我们去研究。Engreitz等人发现,当Xist在染色体中移动时,如果来到了不需要被Xist抑制的基因附近,它们会立刻“跳过去”,这可能与CCCTC结合因子(CCCTC-binding factor, CTCF)有关。因为之前的研究发现,CTCF能够阻止Xist移动。除了能够对基因的转录活动进行调控之外,CTCF因子还可以将DNA链结合在一起,形成染色质环(chromatin loop),通过这种方式来控制染色质的结构。位于不受Xist RNA抑制基因附近的CTCF结合位点可能就是保证这些基因不被Xist RNA结合的障碍物。核基质蛋白——不均一核核糖核蛋白U(heterogeneous nuclear ribonucleoprotein U, hnRNP U)可能与防止Xist RNA“殃及”其它染色体的作用有关,hnRNP U能够帮助Xist从转录位点转移至结合位点上。虽然hnRNP U在核内广泛存在,但是由于在hnRNP U的作用下,Xist与X染色体内的顺式连锁位点(cis-linked loci)的结合力要远远高过与其它染色体的结合力,所以就起到了抑制Xist RNA与其它染色体结合的作用。目前面临的最大的一个问题就是,Xist最终是如何“走遍”整个染色体,对整个染色体发挥作用的。它们是通过弥散的方式,从转录位点一个基因接一个基因的转移至其它位点;还是跨过一个个相对稳定的染色体结构;或者是在染色体动态变动的过程中,在Xist转录位点处新生的Xist RNA得以不断地与其它的结合位点频繁接触,最终被分配到整个染色体上的呢?将来如果开展一些与X染色体失活末期阶段相关的,或者活细胞构象方面的研究工作,有可能会更全面地了解RNA与染色质发生动态相互作用的信息,帮助我们回答上面这些问题。
除了Xist之外,还有一些其它长非编码RNA也都具备一些调控功能,它们也同样的借助了基因组的三维立体折叠机制。这种共性表明,利用空间立体结构的机制可能是细胞内普遍使用的一种调控方法。其它反式作用的(trans-acting)非编码RNA是否也利用了这种机制呢?现在有了RNA结合位点研究技术和基因组构象研究技术,相信在不久的将来,这些问题的答案都将一一地呈现在我们面前。







