在过去一年中,一种叫做CRISPR-Cas系统的基因编辑工具在科学界引起了极大的关注。 CRISPR-Cas系统是在大多数细菌以及古菌中发现的一种天然免疫系统,可用来对抗病毒以及其他病原体对细菌的入侵。科学家利用CRISPR-Cas系统可以对多种细胞的特定的基因组位点上进行切割,以便插入新的遗传物质。
目前已经发现有三种类型的CRISPR-Cas系统,其中其中第二型的组成较为简单,以Cas9蛋白以及向导RNA(guidance RNA)为核心,即CRISPR-Cas RNA引导核酸酶(CRISPR-Cas RNA-guided nuclease,CRISPR-Cas RGN)。不过,最近来自美国麻省总医院的研究者发现CRISPR-Cas RGN也存在重大的局限性,它会在基因组的非目标位置产生非必要的DNA突变,也就是脱靶效应(off-target effect)。
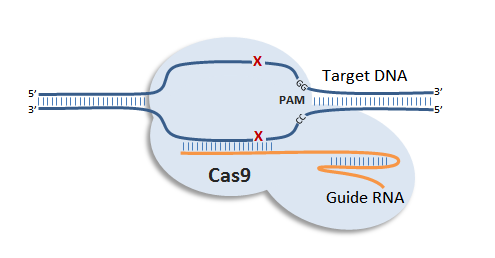
Cas9通过向导RNA结合之目标DNA上并进行切割(切割点:红色X)
这项最新的研究发现在线发表在最新一期的Nature Biotechnology上,研究的共同作者、麻省总医院病理学系的J. Keith Joung博士表示:“我们很惊讶地发现CRISPR-Cas RGN在人类细胞中会产生脱靶效应。”他表示RGN相比其他的基因组编辑技术具有巨大的优势,但是这一新的发现将促使研究者去改善这一工具的精准性。
CRISPR-Cas RGN由DNA切割酶Cas9以及一条含20个核苷酸的RNA短链(作用是与目标DNA链匹配)组成。CRISPR-Cas RGN模拟的正是一些特定细菌的原始免疫系统。当这些微生物受病毒或其他生物感染时,它们会拷贝入侵者的一段遗传编码并整合至自己的DNA中,并遗传给下一代。当子代细菌再次遭遇这些入侵者时,细菌的Cas9在与所整合DNA匹配的RNA链的向导下,在入侵者DNA的目标位置进行切割,从而使病原体失活。
大约一年前,科学家首次报道了利用重编程的CRISPR-CAS RGN靶定并切割特定的DNA位点。此后,不少的研究团队成功地利用CRISPR-Cas RGN对果蝇、斑马鱼、小鼠以及人类细胞——包括诱导多能干细胞进行了基因组编辑。该技术依靠短链RNA片段对目标DNA进行靶定,使其相比其他的基因编辑工具,如ZFN、TALEN等均简单易用,并且RGN经过改造后可同时在一个基因组中引入多个遗传改变。生物探索网站在5月份还介绍过MIT怀特黑德研究所Rudolf Jaenisch教授的研究团队利用CRISPR/Cas技术一次性构建多突变转基因鼠。
但是,CRISPR-Cas RGN可导致额外而非需要的遗传改变的可能性则较少被研究过。因此Joung博士的团队决定对CRISPR-Cas RGN在人类细胞中的脱靶现象进行研究。由于CRISPR-Cas RGN的指导RNA片段与目标DNA只依赖于20个核苷酸进行匹配,因而他们推测这段RNA有可能也会与目标外的其他片段发生结合。
尽管过往的研究表明,即便是一个核苷酸的错配都可以阻止CRISPR-Cas RGN继续发挥作用,但是麻省总医院的这项研究却发现,在人类细胞系中,多达5个核苷酸的错配都未必阻止目标位点外的切割。他们还发现,脱靶位点的突变率与目标位点的突变率相同甚至更高,而这中现象未见于ZFN和TALEN技术。
“我们的研究结果并不是说RGN不是一个重要的研究工具,而是说研究人员需要考虑他们实验中的这些潜在的令人混淆的影响。这些结果也表明现有的RGN平台可能还不可用于治疗应用,” Joung博士说。“我们现在正在研究减少这些脱靶效应的方法,以及用于寻找任何RGN在人类细胞中所有可能的脱靶位点的方法,借此我们可以对所有二代的RGN平台进行评估,看是否会更加精确。我很乐观地认为我们可以对这套系统进行进一步开发,使其更具特异性,从而有望用于人类疾病治疗。”







