感官功能障碍会给人的生活质量和健康带来深刻的影响,不过基因治疗也许可以解决这些问题。基因治疗成功治疗失明——许多的方法还在后期临床试验阶段——给这个曾经停停滞发展领域带来希望。目前,研究基因治疗的科学家们正在将自己的专注点拓展到所有的感官功能障碍上。

去年,科学家们成功地利用基因治疗恢复了小鼠原本已经失去的听觉与嗅觉功能。还有一些研究团队正通过基因治疗解决疼痛管理问题,希望能够克服一直存在的阿片类药物的耐受性问题。这些治疗方法中有一些已经开始了人体试验,并且,随着将病毒载体和其他遗传物质注射到患者体内这一难题的解决,科学家认为将来有一天可以通过一次注射就能治愈耳聋、嗅觉缺失等各种感觉障碍。
基因疗法治疗耳聋
去年基因治疗领域一个著名的案例,就是加州大学的耳鼻喉专家Lawrence Lustig与同事们利用基因治疗恢复了小鼠的听力。谷氨酸是一种重要的神经递质,起到将对声音震动做出反应的内耳毛细胞与将信号传递至大脑的听觉神经元连接的作用。事实上,在囊泡谷氨酸转运体-3(VGLUT-3)基因——负责内耳毛细胞上谷氨酸的释放——上的一个错义突变与人类的一种耳聋相关。在携带VGLUT-3基因缺陷的小鼠中,Lustig的团队通过表达VGLUT-3蛋白而成功恢复了突变小鼠的内耳毛细胞的一些功能。
“VGLUT-3基因突变小鼠的神经元在等着神经递质对其进行激活”,但是信号并没有出现,小鼠因而严重失聪。但是当科学家用未被沉默的VGLUT-3基因对图标小鼠进行基因治疗后,小鼠的神经元开始重新传递信号,它们对突然发出的噪声的惊吓反应恢复到了正常小鼠的三分之一。
Lustig认为这个结果非常令人鼓舞,并正在将这种治疗方法拓展应用到其他形式的遗传性失聪治疗中。但是与完全失去VGLUT-3蛋白的小鼠不同,人类中的这种错义突变会表达出有缺陷的转运子,所以目前还不清楚Lustig的这种治疗策略是否在人类VGLUT-3相关耳聋治疗中行得通。
另外有一些研究者正在研究基因治疗是否可以用作对目前通用的失聪治疗——人工耳蜗的补充。失聪通常是由毛细胞缺失或受损无法向听觉神经元传递信号而导致的,人工耳蜗可以对声音做出反应并将电子信号传递给神经细胞。但是随着修复的毛细胞所释放的生长因子变少,这些神经细胞通常会退化。
在2012年,一个团队的带领下,内耳在密歇根大学的生物学家,设计了一种基因治疗,以防止听觉神经元变性的实验性聋豚鼠内耳毛细胞已被摧毁的新霉素注射Yeohash拉斐尔。研究人员利用病毒载体刺激豚鼠内耳上皮细胞产生神经生长因子,促使听觉神经萌芽,尽管投入的不足,从毛细胞人工耳蜗上皮细胞。
在2012年,美国密歇根大学的生物学家Yeohash Raphael领导的团队设计出了一种基因疗法,可以阻止由于新霉素注射导致失聪的实验豚鼠的听觉神经退化。研究人员利用病毒作为载体,刺激豚鼠的内耳上皮细胞产生神经生长因子,促进听觉神经生长并接近耳蜗上皮细胞。
由于这些豚鼠没有毛细胞,因此这种治疗无法让它们恢复自身的听力,但是促进听觉神经伸张并靠近人工耳蜗可以帮助其传递信号至神经细胞,提高人工耳蜗成功发挥功能的几率。
基因疗法治疗嗅觉障碍
味觉和触觉曾经是基因治疗研究者很少关注的领域,不过现在这一情况正在发生改变。去年,美国密歇根大学的研究者利用基因治疗恢复了小鼠由于遗传缺陷而失去的嗅觉功能。
“对于嗅觉障碍,很少有有效的疗法,”领导这项研究的药理学家Jeffrey Martens说。多数情况下,嗅觉纤毛——在气体分子与嗅觉神经细胞间传递信号的重要结构——会由于衰老后创伤而受损,也有一些嗅觉缺失症是由于遗传缺陷引起的。
Martens的研究团队所研究的小鼠在编码IFT88蛋白——一种对纤毛结构非常重要的蛋白——的基因中携带一个突变。这种小鼠通常被用作研究一种肾病的模式动物。纤毛在各种器官——包括肾脏——中非常重要。研究人员发现这种疾病模式小鼠的嗅觉纤毛数量少且功能异常,与正常小鼠相比,这种小鼠体型也较小——这表明由气味引导的行为(如进食)被扰乱了。
利用携带野生型Ift88基因的病毒载体对小鼠实施鼻内基因治疗,研究人员发现小鼠的鼻纤毛出现了明显的再生,而用空病毒载体进行处理的对照小鼠则没有这种情况。在体重上,接受治疗的小鼠差不多是对照小鼠的两倍。
Marten说,这项研究表明,基因疗法可以治疗三分之一甚至更多的由于先天性纤毛疾病导致的嗅觉功能障碍。这项研究也为治疗其他器官(如肾脏和视网膜)的与纤毛相关疾病带来了希望。
基因治疗改善味觉
到目前为止,还没有科学家研究出针对味蕾的基因治疗,不过至少有一个研究团队正在解决与味觉相关的一个重要因素:唾液。如果一个人的唾液产生量低于正常量的50%,他会出现龋齿以及吞咽困难。如果没有唾液来溶解味道分子,“你不能正常地尝到味道,”Bruce Baum说,他是一位牙医和分子生物学家。
大多数的人从来没有经历过口干,但是对于那些患头部或颈部癌症的人来说,因为放射性治疗而导致唾液腺腺泡细胞严重受损,失去唾液腺功能是一个残酷的现实。由于放射治疗摧毁了过多的腺泡细胞(负责释放唾液的水分),用来刺激唾液产生的药物所能起到的作用也极其有限。
Baum和他的同事决定,通过刺激另一种唾液腺细胞——叫做导管细胞——表达一种水通道形成蛋白(水通道蛋白),将导管细胞变为产唾液细胞。2012年,研究者报告了在11位进行过头部或颈部癌症放射治疗的患者中开展的I期临床试验。Baum和同事发现,将含水通道蛋白基因的病毒载体输注到患者的一个唾液腺42天之后,6位患者的唾液量提高了,另5位患者的口干症状也减轻了。
这种治疗策略还需要进一步优化,但是Baum表示首次临床试验是一个合理的策略,向人们证实了这种新型的疗法可以解决那些影响生活治疗的疾病。
基因治疗缓解疼痛
科学家正在开发用于治疗与触觉——或者说至少是痛觉——有关的基因疗法。目前已经有一个候选药物通过了I期临床试验。该药物利用具有复制缺陷的单纯性疱疹病毒(HSV,正常情况下会导致唇疱疹)载体在神经细胞中表达身体自身的止痛物质。
一些患者往往会产生对阿片类药物如吗啡的耐受性,需要更大剂量的这类药物才能缓解疼痛,PeriphaGen公司的CEO、分子生物学家Darren Wolfe说。Wolfe希望,通过向疼痛中心附近的神经细胞靶向递送镇痛药物可以实现低剂量缓解疼痛,并防止产生药物耐受的目的。在2011年的I期临床试验中,Wolfe的团队利用携带编码止痛分子——前脑啡肽原(preproenkephalin)基因的HSV载体,对10位有顽固性疼痛的末期癌症患者进行了治疗。据报道,6为接受最高剂量的患者在接受治疗2周后疼痛感下降了80%。目前,该疗法正在计划开展II期试验。
PeriphaGen还正在计划开展一种治疗糖尿病性神经病变的基因疗法的I/II期试验,其所用的载体携带编码神经递质γ-氨基丁酸(GABA)的基因。慢性糖尿病造成的神经受损会给病人带来痛感的灼烧和刺痛感。Wolfe设想,将来有一天疼痛治疗会简单到如同几个月做一次皮试一样简单,在各种基因治疗中选择一种就可以达到最佳的效果。
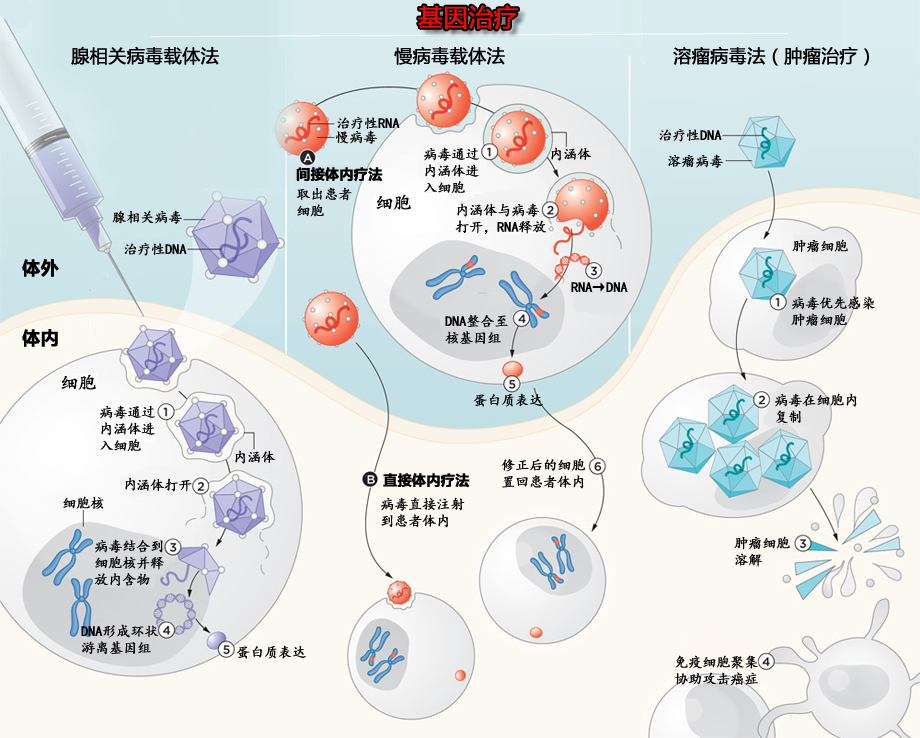
基因治疗图示