癌症驱动事件是指驱动肿瘤发生的关键基因畸变;然而,它们的确切分子机制仍然没有得到充分的了解。
2023年8月14日,临床蛋白质组学肿瘤分析联盟(CPTAC),丁莉等人作为通讯作者在Cell 在线发表题为“Pan-cancer proteogenomics connects oncogenic drivers to functional states”的研究论文,该研究的多组学泛癌症分析通过确定其在RNA、蛋白质和磷蛋白水平上量化的显著顺式效应和远端反式效应,揭示了对癌症驱动因素影响的见解。

突出的观察结果包括点突变和拷贝数改变与蛋白质相互作用网络重新连接的关联,值得注意的是,大多数癌症基因趋同于基于序列的激酶活性谱所表示的相似分子状态。预测的新抗原负担和测量的T细胞浸润之间的相关性表明免疫疗法的潜在脆弱性。癌症特征的模式因多基因蛋白丰度而异,从均匀到不均匀。总的来说,该研究证明了综合蛋白质基因组学在理解致癌驱动因素的功能状态及其与癌症发展的联系方面的价值,超越了研究单个癌症类型的局限性。
另外,2023年8月14日,临床蛋白质组学肿瘤分析联盟(CPTAC),丁莉等人作为通讯作者在Cell 在线发表题为“Pan-cancer analysis of post-translational modifications reveals shared patterns of protein regulation”的研究论文,该研究分析了来自11种癌症类型的1110例PTM患者的最大蛋白质基因组学数据集(其中10例来自美国国家癌症研究所临床蛋白质组学肿瘤分析联盟[CPTAC])。该研究揭示了参与标志性癌症过程的蛋白质乙酰化和磷酸化的泛癌症变化模式。这些模式揭示了来自不同癌症类型的肿瘤亚群,包括那些由磷酸化驱动的DNA修复失调,由乙酰化驱动的与免疫反应相关的代谢调节改变,由乙酰化和磷酸化之间的串扰影响激酶特异性,以及修饰的组蛋白调节。总的来说,这一资源突出了PTM控制的丰富生物学,并揭示了潜在的新治疗途径。

2023年8月14日,临床蛋白质组学肿瘤分析联盟(CPTAC),丁莉等人作为通讯作者在Cancer Cell 在线发表题为“Integrative multi-omic cancer profiling reveals DNA methylation patterns associated with therapeutic vulnerability and cell-of-origin”的研究论文,该研究利用687个肿瘤的多组学分析和来自肾脏、脑、胰腺、肺、头颈部和子宫内膜的匹配非累及邻近组织来识别与RNA和蛋白质丰度变化相关的异常甲基化,并建立泛癌症目录。该研究发现了谱系特异性的表观遗传驱动因素,包括子宫内膜癌中FGFR2低甲基化。该研究发现高甲基化的STAT5A与普遍的调控子(regulon)下调和免疫细胞消耗有关,这表明STAT5A表达的表观遗传调控构成了鳞状肿瘤免疫抑制的分子开关。该研究进一步证明甲基化亚型富集信息可以解释细胞起源、肿瘤内异质性和肿瘤表型。总体而言,该研究确定了驱动转录和翻译变化的顺式作用DNA甲基化事件,揭示了肿瘤的表观遗传景观及其起源细胞的作用。

2023年8月10日,临床蛋白质组学肿瘤分析联盟(CPTAC),丁莉等人在Cancer Cell在线发表题为“Proteogenomic insights suggest druggable pathways in endometrial carcinoma”的研究论文,该研究使用10种不同的组学平台对一个前瞻性子宫内膜癌(EC)队列进行了特征描述,该队列包含138个肿瘤和20个富集的正常组织。两种多肽的靶向定量可以预测抗原加工和递呈机制活性,并可能为患者选择免疫治疗提供信息。在患者和细胞系中MYC活性与二甲双胍治疗之间的关联分析表明,二甲双胍治疗在MYC活性升高的非糖尿病患者中具有潜在作用。PIK3R1框架内索引与AKT磷酸化升高和对AKT抑制剂的敏感性增加有关。CTNNB1热点突变集中在介导pS45诱导的β-catenin降解的磷酸化位点附近,这可能导致Wnt-FZD拮抗剂无效。深度学习可以准确预测EC的亚型和突变,这可能有助于快速诊断。总的来说,本研究确定了分子和影像学标记物,可以进一步研究指导患者分层,以更精确地治疗EC。

癌症主要由肿瘤抑制基因(TSGs)和原癌基因的基因驱动突变引发。将基因定义为癌症驱动因素的多个指标被认为是,包括基因的突变复发,功能蛋白结构域,致癌突变的单个氨基酸热点,破坏性突变的富集,或蛋白质结构中体细胞突变的三维聚类。在将这些标准应用于大量癌症基因组学数据时,癌症基因及其预测驱动突变的列表近年来有所增长。这些突变如何在机制上“驱动”肿瘤发生仍不完全清楚。
临床蛋白质组学肿瘤分析联盟(CPTAC)通过整合整个蛋白质基因组谱的数据,加速了对癌症基本分子机制的理解:全外显子组和全基因组测序、DNA甲基化、RNA-seq、综合蛋白质组学和磷蛋白质组学。迄今为止,已有1000多例病例的广泛数据,涵盖10种癌症类型:结直肠腺癌(COAD)、卵巢高级别浆液性癌(HGSC)、透明细胞肾细胞癌(ccRCC)、头颈部鳞状细胞癌(HNSCC)、肺鳞状细胞癌(LSCC)、子宫内膜癌(UCEC)、肺腺癌(LUAD)、胰腺导管腺癌(PDAC)、胶质母细胞瘤(GBM)和乳腺癌(BRCA)。通过对不同组学层的改变的研究,体细胞驱动突变的影响可以追踪到生物结构和功能的单位:蛋白质。
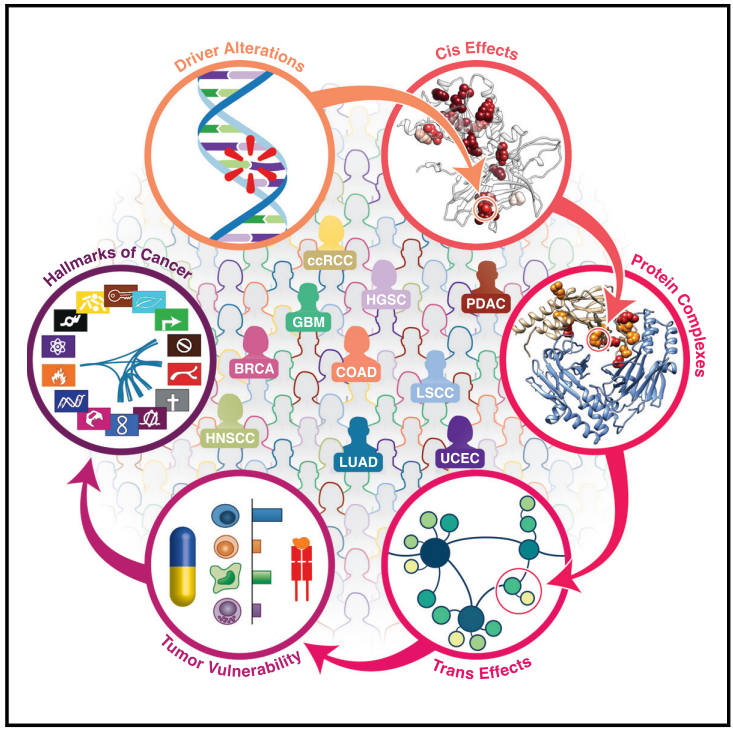
文章模式图(图源自Cell )
泛癌症研究的重点是确定不同癌症的分子特征。该研究扩展了之前以基因组学为中心的泛癌症研究,结合蛋白质组学层来阐明癌症驱动因子的六个关键方面:(1)泛癌症基因组和表观基因组驱动因子的频率、排他性和共现性;(2)驱动因子改变对RNA、蛋白质和翻译后修饰(PTMs)的影响;(3)驱动因子改变对蛋白质复合物的影响;(4)致癌途径中必需蛋白和磷酸化水平的变化;(5)可操作的驱动改变与肿瘤微环境(TME)的关联;(6)从癌症特征的角度研究体细胞驱动因子对蛋白质丰度的综合影响。该研究结果显示了整合蛋白质基因组分析在解码致癌驱动因素及其潜在临床应用方面的潜力,特别是在缺乏明确基因组目标的情况下。
文章来源“iNture”