从一级市场火到二级市场,都在关注高尿酸血症、痛风、URAT1抑制剂。为什么火,无非是市场空间大,临床需求未满足,同时竞争也很激烈。
为什么说市场空间大?
我们只看几个数字:2021年,全球高尿酸血症10.5亿人;痛风患者2.2亿;中国高尿酸血症1.75亿人,痛风患者3600万人。巨大的人群,已然成为高血压、高血糖、高血脂之外的“第四高”,而且越来越年轻化,谁还没有几个高尿酸的小伙伴。
为什么说还有巨大的未满足临床需求?
我们看看目前的一线用药:根据中国内分泌代谢杂志2019年发布的《中国高尿酸血症与痛风诊疗指南》,目前对于复发性急性/慢性痛风的一线治疗药物为黄嘌呤氧化酶抑制剂和URAT1抑制剂。
黄嘌呤氧化酶抑制剂通过抑制黄嘌呤氧化酶来减少尿酸的产生,但该机制相应人群(尤其是亚洲患者)不高。代表药物包括上世纪60年代上市的别嘌醇以及2009年美国获批上市的非布司他。然而别嘌醇被发现有可能导致致死率高达30%的超敏反应(2.7%),非布司他则存在心血管风险而被FDA打上黑框警告。
URAT1抑制剂通过抑制肾小管尿酸重吸收来促进尿酸排泄,其代表药物为上世纪70年代上市的苯溴马隆和丙磺舒。苯溴马隆在欧美因其有引起爆发性肝坏死的案例而被停用或作为二线药物使用,但在中国仍然是处方量最大的痛风药。而丙磺舒在2019年被国家医保目录移除,说明其临床价值不被认可。2015年在美国上市的雷西纳德则因急性肾衰竭风险升高而被FDA黑框警告,2019年在美国停止销售,至今未在中国上市。
简而言之,一线药各有各的疗效和安全性问题,巨大的中国高尿酸血症/痛风人群亟需兼具疗效和安全性的痛风药出现。
为什么是URAT1?
尿酸在人体内的代谢水平与肾脏尿酸盐重吸收转运蛋白有关。尿酸盐重吸收转运蛋白包括尿酸盐转运体 1(URAT1)等。URAT1 位于近曲小管的管腔膜上,负责将尿酸盐从小管液(尿液)中重吸收到近曲小管细胞。URAT1 抑制剂可以通过抑制尿酸盐的重吸收,从而促进尿酸从体内的排泄并降低血尿酸水平。
10%的高尿酸血症是因尿酸的过度生成而导致,适用黄嘌呤氧化酶抑制剂。90%的高尿酸血症都是由肾脏尿酸排出缺陷造成的,适用URAT1抑制剂(促尿酸排泄)。URAT1的地位可想而知,即便苯溴马隆、雷西纳德身世坎坷,后来者都清一色的选择URAT1作为研发方向。
重点来了,众多URAT1研发管线,
究竟谁能笑到最后?
本文试图通过整理公开信息,按图索骥,捋清国内URAT1研发管线竞争情况,不判高下,只究事实。
截至2022年底,国内外URAT1抑制剂痛风在研项目有20个。在中国宣布进入II期的主要管线如下表:
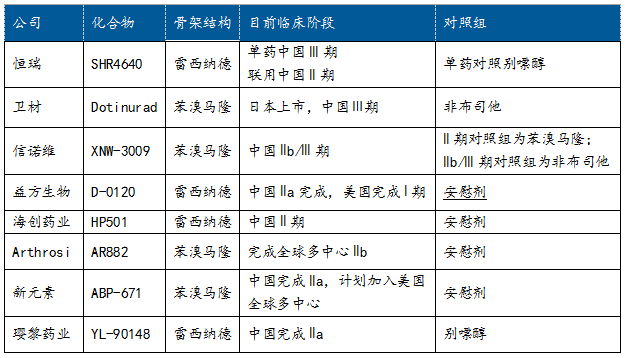
1、苯溴马隆系列or雷西纳德系列,URAT1的主战场
如上表所示,目前进度较快的在研管线的母核结构均基于雷西纳德或苯溴马隆。恒瑞、益方、海创、璎黎骨架结构接近雷西纳德;卫材、信诺维、Arthrosi、新元素骨架结构接近苯溴马隆。各显神通,争做Best in Class。
苯溴马隆因其肝毒性被诟病多年。文献报道,苯溴马隆的肝毒性由其被代谢为能与蛋白质加成的苯醌类似物导致。苯溴马隆生物激活的合理情况可能涉及CYP2C9介导的苯并呋喃环相邻碳上的芳基氧化,产生对苯二酚,然后对苯二酚可以进一步氧化为反应性对醌中间体。然后,对醌可能在半胱氨酸残基处加合细胞蛋白,导致肝毒性。所以,避免中间产物“对苯醌”的产生是苯溴马隆改构的核心要点。而验证改构是否成功的标准很简单:代谢产物中是否含有“对苯醌”或类似物。
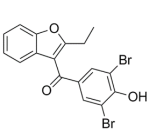
苯溴马隆结构式
雷西纳德的研发上市历程似乎更加坎坷。于2015年12月FDA获批,2016年02月EMA获批,仅获批联用黄嘌呤氧化酶抑制剂(XOI),2019年在美国停止销售。原因是急性肾功能损伤的风险,其机理尚不明确。由此可见,雷西纳德药效和安全性都存在问题,对后来研发者提出更高要求。
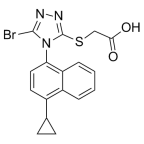
雷西纳德结构式
2、疗效好不好,阳性对照比一比
目前在研的管线似乎都做了随机双盲实验,但有的是阳性对照,有的是安慰剂。笔者简单粗暴的认为,阳性对照才是硬道理。原因在于不同的临床试验,临床结果差异巨大。以苯溴马隆50mg为例,在SHR4640、Dortinurad、XNW3009三个对照试验中,苯溴马隆的达标率分别为61.5%、83.6%和51.9%。不同试验受样本量、入组标准、临床管理等各种因素的影响,并不具备可比性。所以阳性对照才是硬道理。我们看看几组阳性对照数据:
SHR4640单药对比苯溴马隆治疗高尿酸血症的II期研究(201研究,NCT03185793)显示,治疗5周后sUA≤360μmol/l达标率分别为:32.5%(SHR 5 mg)、72.5%(SHR 10 mg)和61.5%(苯溴马隆 50 mg)。
Dortinard公布的治疗有或无痛风的高尿酸血症患者的安全性和非劣效性研究,给药方案见下图,Dotinurad 2 mg血尿酸达标率为86.2%,苯溴马隆50 mg为83.6%。
XNW3009公布的II期临床数据显示,0.5mg剂量组每次给药即可实现血清尿酸浓度≤360umol/L的受试者比例超过72%,而苯溴马隆50mg对照组血清尿酸浓度≤360umol/L的受试者比例为51.9%。
3、中国临床or美国临床?这不是一道选择题
各公司宣称的临床阶段似乎眼花缭乱,IIa、IIb、II/III;有中国临床,有美国临床,有国际多中心。比如益方、新元素、Arthrosi似乎都把目光投向了美国市场,启动国际多中心。笔者不做评述,但历史经验告诉我们,苯溴马隆和雷西纳德在美国的经历有多惨,这几家美国临床的路就有多难走。美国慢性病用药临床难度极大,临床样本量大,安全性条件苛刻,更何况,URAT1抑制剂根本就不在美国临床一线用药里。国际多中心玩家只能自求多福。
4、谁在III期谁在混,CDE早晚收拾你
回到中国临床,笔者发现,CDE对URAT1III期临床要求越来越苛刻。我们来捋一捋CDE的尺度变化:
2019年,恒瑞获准进入III期临床,对照别嘌醇(II期对照苯溴马隆),起初样本量是288例,2021年样本量改为708例,历经三年还未公布结果,而在2022年11月重新启动了联合非布司他的II期,一路坎坷。是否因为化合物和雷西纳德属于同一系列,临床开发也遇到了类似的问题,笔者不得而知。
再看Dortinard,在日本III期临床,分别做了苯溴马隆和非布司他的非劣,成功上市。2022年进入中国的III期,要求做非布司他优效。
XNW3009在Dortinard之后进入IIb/III期,对照非布司他(II期对照苯溴马隆)。
其他没有阳性对照的管线均未进入IIb或III期。几乎可以肯定的是,除了Dortinard和XNW3009,其他人都需要重新做II期。而且此刻的II期,大概率只能双盲对照非布司他了。
由此可见,CDE对于URAT1的临床要求在提高:进III期前的阳性对照试验似乎成了必要条件,III期的对照组也只可能是非布司他。在中国进III期,谈何容易。
总而言之,创新药前路艰险,国内的URAT1领跑者走到今天实属不易,但革命尚未成功,同志仍需努力!






