导语:每年夏天,大家总是会抱怨:天气太热了,都快“热死了”。在这炎热的夏季,中暑不是什么罕见事,高温环境下,人们或多或少会出现头晕、眼花、多汗、恶心等中暑症状。通常来说,很多人认为多喝点水,休息一下就能恢复。但是,如果是重症中暑(即热射病),人体可能会出现全身炎症反应、循环衰竭、弥散性血管内凝血和多器官衰竭等症状,从而带来永久性伤害甚至死亡。
2022年5月5日,中南大学湘雅三医院吕奔教授团队在Science发表题为“Z-DNA binding protein 1 promotes heatstroke-induced cell death”的研究成果(图1)。该研究揭开了热射病致死的重要机制—高体温通过Z-DNA结合蛋白-1(Z-DNA binding protein 1,ZBP1)诱发过度的程序性细胞死亡,进而导致弥散性血管内凝血(Disseminated Intravascular Coagulation,DIC)与多器官衰竭。

图1 研究成果(图源:[1])
沿用前期开展的脓毒症研究思路,该团队模拟出高温度(39℃)、高湿度(60%±5%)的环境,以构建小鼠中暑模型,发现高体温通过触发受体相互作用蛋白激酶3(Receptor interacting protein kinase 3,RIPK3) 导致依赖性细胞死亡,从而导致DIC与多器官衰竭。
在此前的动物试验中,有科学家发现细胞的程序性死亡受到混合系激酶区域样蛋白(Mixed lineage kinase domain-like,MLKL)的调控,即MLKL被激活时可以导致坏死性凋亡(也就是热射病中细胞死亡的方式),这是一种由信号激活的细胞自我破坏过程。另一方面,MLKL的激活受到了RIPK3的调控。
因此,团队试图通过RIPK3通道、MLKL敲除来证实热射病的致死效应。在敲除RIPK3基因后,处于高温度、高湿度的小鼠几乎没有出现因高体温诱发的炎症反应、DIC、多脏器衰竭等相关症状。在敲除了MLKL基因后,小鼠大多数活了下来。
上述实验证实热射病中的程序性细胞死亡主要是通过诱发RIPK3,以及RIPK3磷酸化底物MLKL介导所导致的。
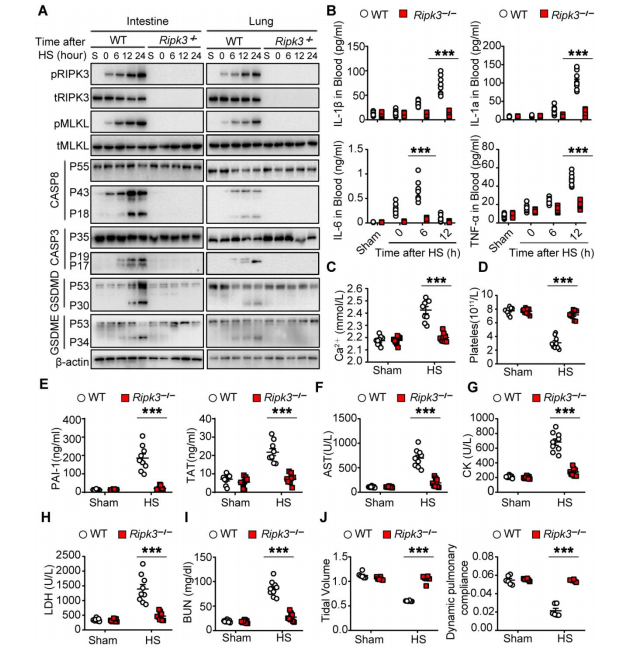
图2 RIPK3介导热应激诱导的细胞死亡和热射病症状(图源:[1])
根据上述依据,研究团队又发现热应激能诱导ZBP1的表达。实验中,研究人员发现,在敲除ZBP1基因后的小鼠,能减少一些热射病症状,证实了ZBP1在热应激诱导的程序性细胞死亡的关键作用。此外,研究人员还发现,ZBP1基因启动子中存在热休克因子1(HSF1)的结合元件,证实了热应激可以通过诱导HSF1与ZBP1基因启动子来增强ZBP1的表达,并且热应激诱导的ZBP1活化不依赖于核酸识别。这些发现颠覆了此前学术界对ZBP1的看法,进一步揭示了ZBP1激活新机制。
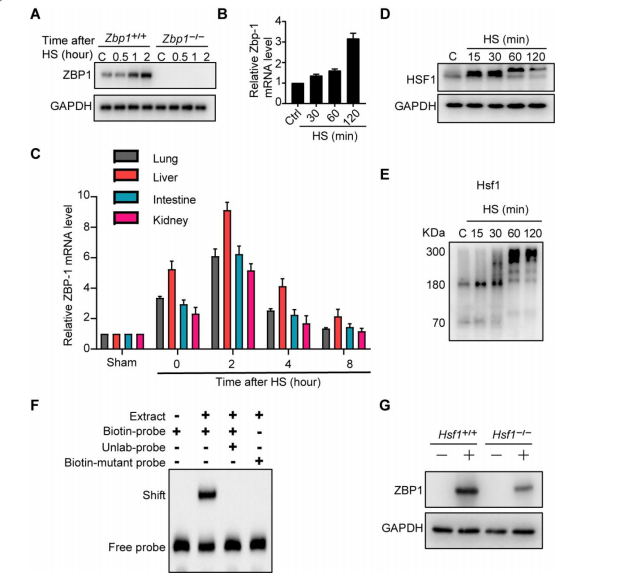
图3 热应激通过HSF1增加ZBP1的表达(图源:[1])
这项研究明确揭示了当受到热应激时,ZBP1与RIPK3依赖的程序性细胞死亡或被诱发。虽然高体温可通过激活ZBP1以促进抗感染免疫反应,但持续性高温环境会过度激活细胞程序性死亡,最终引起人体出现全身炎症反应、循环衰竭、DIC和多器官衰竭等症状,甚至会使患者出现死亡风险。
这项研究揭秘了热射病致死的关键机制,揭示了在高温环境下会过度激活细胞程序性死亡,从而进一步展示了ZBP1激活新机制,程序性细胞死亡与多器官衰竭之间的内在联系,为热射病等危重症提供了有效防治策略。
题图来源:稿定设计,仅用于学术交流。
撰文|郭亚青
排版|文竞择