本文转载自“中国生物技术网”公众号。
常言道“人无压力轻飘飘,一有压力睡不好”。为啥有压力会“睡不好”?其背后的机制是什么?会导致什么后果?
北京时间2022年1月22日凌晨0时,中国科学院深圳先进技术研究院脑认知与脑疾病研究所、深港脑科学创新研究院王立平团队发表于Cell Press的最新研究成果,对这些问题进行了解答。
助理研究员曾渝婷、研究助理赵炳皓、在读博士生陈善平为论文共同第一作者,王立平研究员为通讯作者。

图1. 研究成果(图源:Cell Press)
正常的睡眠包括快速眼动睡眠(rapid eye movement,REM)和非快速眼动睡眠(non-rapid eye movement,NREM)两种状态。当人处在快速眼动睡眠状态时,会表现出眼球不停地左右摆动、心率加快、血压升高、肌肉松弛等表现。大部分的梦也发生在快速眼动睡眠阶段。快速眼动睡眠在1953年就已经被观测到,过去七十年以来,其机制和功能仍是不解之谜。在以往的临床研究中,睡眠障碍与压力、恐惧相关的精神疾病有高共患率,如抑郁症和创伤后应激障碍等精神疾病中,都出现了显著的快速眼动睡眠状态的改变。但是由于快速眼动睡眠的机制和功能不清晰,很大程度上限制了我们深入理解与睡眠障碍共患的众多精神疾病的发生和干预机制。
面对这一重要问题,团队首次揭示了调控快速眼动睡眠与本能恐惧反应的“共享”神经环路,此“共享”环路的发现揭示了快速眼动睡眠具有潜在“防御天敌”功能,为精神疾病中快速眼动睡眠的失调提供了可能的解释,为睡眠障碍及本能恐惧失调相关精神疾病共患病的诊断与治疗提供了可能的靶点。
“睡不好”与本能防御的天性有关
人们常说,一夜无梦是为“睡得好”,而做了噩梦或失眠则被认为“睡不好”。做梦是在睡眠阶段的一个正常的生理现象,要理解梦的发生,则需要先了解睡眠结构。
1966年,美国的心理生理学家Frederick Snyder提出快速眼动睡眠可能扮演“哨兵功能”的假说,该假说认为周期性的快速眼动睡眠后常伴随着短暂的觉醒,使得动物能够检测环境中的危险,然而这一假说并未能提供实验证据支持。
一直以来,王立平团队致力于进行动物本能恐惧防御行为神经机制研究,针对该假说,研究团队设计了相关实验以研究睡眠阶段是否能够激发本能防御行为,以响应天敌的威胁,并探索背后的神经机制。
狐狸是小鼠的天敌,在清醒状态下,狐狸尿液气味(TMT)可以迅速引起小鼠的本能恐惧逃避行为。研究人员在快速眼动睡眠阶段给予小鼠TMT刺激,发现小鼠醒来的速度显著比在非快速眼动睡眠阶段给予刺激要更快。而用闻起来像肉桂面包味的香气和臭鸡蛋气味的气体刺激小鼠都没有这种效果。这说明快速眼动睡眠能够特异性地响应天敌刺激。
有压力“睡不好”背后的神经机制
综合使用团队自主研发的小动物眼动监测、以及内窥镜单神经元成像、化学遗传学调控等方法,团队发现相比非快速眼动睡眠,在快速眼动睡眠期间给予动物天敌气味刺激能够更快唤醒小鼠,提示快速眼动睡眠具有潜在“防御天敌”的功能,并且成功解析了一条小鼠大脑中从丘脑底核(medial subthalamus nucleus, mSTN)促肾上腺皮质激素释放激素(corticotropin releasing hormone , CRH)神经元投射到外侧苍白球(lateral globus pallidus, LGP)的神经环路,该神经环路调控了快速眼动睡眠下对天敌刺激的响应。
研究团队发现该神经环路中的CRH神经元不仅在维持快速眼动睡眠稳定性中发挥着重要的作用,并且对天敌危险信息特别敏感。抑制这群神经元减少了快速眼动睡眠的长度,但在天敌刺激下小鼠醒来的更慢。在动物觉醒情况下,这群神经元同样参与对天敌恐惧刺激的调节。
这为快速眼动睡眠可能扮演“哨兵功能”的假说提供了实验证据,并为该假说提供了神经机制上的解释。
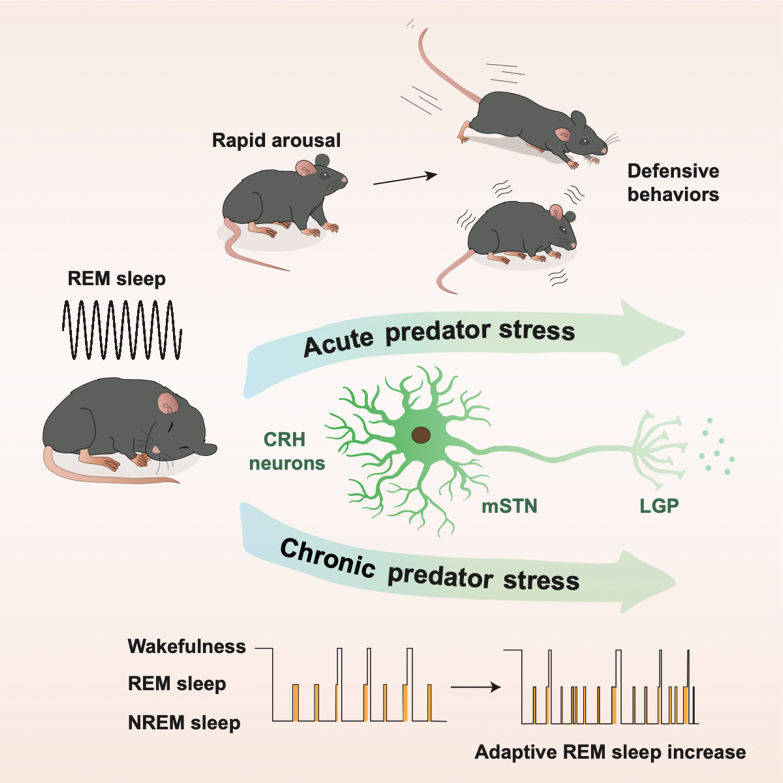
图2. mSTN-CRH-LGP神经环路调控快速眼动睡眠和防御行为。(图源:科研团队供图)
“尽管本能防御的天性可能是‘睡不好’的原因之一,然而随着社会的演进与发展,人类并不需要应对自然状况下的天敌。原本保守的天敌防御环路可能被应用于应对社交压力等外界刺激。同样,噩梦的发生、外界压力、不当的睡眠姿势、疾病状态等都会影响人的睡眠”,论文第一作者曾渝婷表示,长期睡眠问题下会导致心理健康受到影响,甚至造成抑郁症等精神疾病的发生。
为精神类疾病治疗找到潜在靶点
如果说快速眼动睡眠的功能与逃避天敌有关的话,那么长期天敌压力应激下小鼠是否会发生快速眼动睡眠结构的变化?
对此,研究人员使用大鼠对小鼠进行慢性长期压力模拟实验,发现在长期压力应激下,小鼠的快速眼动睡眠结构显著改变,表现为快速眼动睡眠时间的延长以及睡眠的片段化。使用化学遗传学的方式,抑制小鼠的CRH神经元活性则消除了小鼠的快速眼动睡眠结构的变化。
“同一群神经元同时调控睡眠和本能防御行为,而不是进化出两套相对独立的神经调控网络,这在演化上讲是极其重要的。我们可以假设,在自然选择中机体对现有神经环路进行‘共享’优化从而提高信号传导和能量使用的效率,而不是去选择代谢上更耗费资源的方案,例如选择截然不同的两个环路。换句话说,进化就像是建筑师在古老的建筑上进行加工,而不是从零开始重新设计一个建筑” ,论文通讯作者王立平表示。
复旦大学基础医学院副院长、药理学系主任黄志力表示,此项研究也提示了这一“共享”神经环路可能是帕金森病人接受丘脑底核深部脑刺激治疗时造成抑郁情绪和睡眠状态改变的原因,为共患睡眠障碍及本能恐惧失调相关精神疾病的治疗提供了潜在靶点。
中国人民解放军陆军军医大学教授胡志安表示,过去半个世纪以来,人们对快速眼动睡眠的功能一直不确定。该研究提示快速眼动睡眠重要功能之一是“在保持睡眠的同时,使个体具备对环境威胁保持警觉和反应的能力”。这是一个非常有价值的科学发现,有望拓展人们对睡眠功能机制的认知,并为理解睡眠障碍的机理提供重要的科学依据。
排版|乔维钧
参考资料:
[1]Tseng YT, Zhao B, Chen S, et al. The subthalamic corticotropin-releasing hormone neurons mediate adaptive REM-sleep responses to threat. Neuron. 2022 Jan 13:S0896-6273(21)01088-6. doi: 10.1016/j.neuron.2021.12.033. Epub ahead of print. PMID: 35065715.