近日,亘喜生物在第65届美国血液学会(ASH)年会上以口头报告方式汇报了BCMA/CD19 FasTCAR-T疗法GC012F一线治疗高危多发性骨髓瘤新确诊患者(NDMM)的一期IIT最新数据。

喜报登台:GC012F一线治疗NDMM临床数据惊艳
NDMM是亘喜生物基于GC012F的安全性优势,在多发性骨髓瘤领域前瞻性布局的一条赛道。早在去年ASH年会,公司就首次公布了这项IIT 研究的临床数据,安全性和疗效都非常好;今年9月的IMS年会上,又做过数据更新,此次能继续入选ASH 2023口头报告,不难看出业界对于GC012F针对NDMM一线治疗抱以厚望。
截至2023年10月1日,22例可评估患者中位随访时间18.8个月,疗效方面:ORR依旧高达100%,sCR率也高达95.5%,MRD- 率同样保持了100%,中位DOR和中位PFS数据尚未成熟。
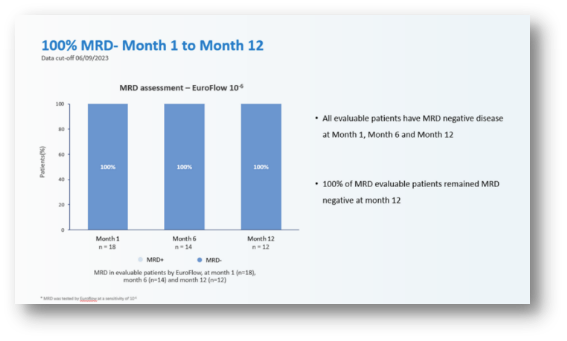
图片来自ASH官网摘要信息
安全性方面,GC012F延续了一贯的卓越表现。仅27%(6/22)的患者出现细胞因子释放综合征(CRS),且均为低级别,包括1级(23%,5/22)和2级(5%,1/22)。未观察到患者出现任何级别的ICANS或其他神经毒性。
还需要指出的是,近期FDA针对CAR-T治疗与出现T淋巴细胞瘤的关联极为关注。目前其实也无法断定少部分患者的严重不良事件,是CAR-T疗法还是既往多重疗法积累的结果。但不管如何,安全性一定会是CAR-T行业密切关注的重大议题。对于一路高挂“安全旗”的GC012F而言,其实在今年ASCO披露的RRMM临床数据披露中,就强调过未出现第二原发肿瘤(SPM)事件,在此次NDMM临床中,依然没有看到任何有关SPM事件的报告。
喜拓自免:难治性系统性红斑狼疮IND获FDA批准
GC012F的优异安全性,为其拓展更广的治疗领域奠定了坚实基础。就在两周前,亘喜宣布GC012F治疗难治性系统性红斑狼疮的1/2期临床试验申请获得FDA批准。
不同于肿瘤的治疗,自身免疫性病作为一种慢性、不会迅速危及生命的疾病,监管机构对于其治疗的安全性要求更高。
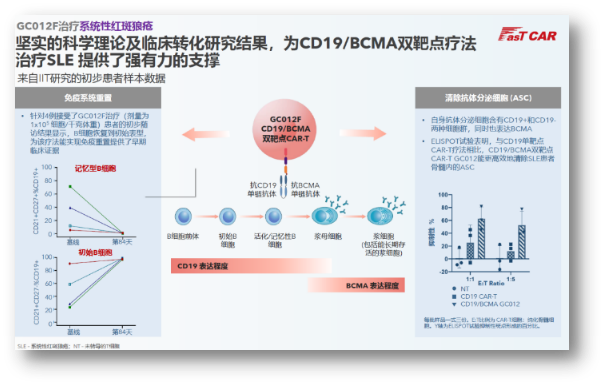
亘喜在今年5月宣布启动GC012F治疗rSLE的IIT研究,正式将双靶点CAR-T疗法拓展到自免领域。随着越来越多细胞疗法玩家加入到自免赛道的竞逐中,上个月,首届美国自身免疫性疾病细胞疗法峰会正式召开,亘喜生物CBO在会上介绍了GC012F如何应用于rSLE适应症的原理,同步披露了4例患者的早期转化样本结果:治疗后B细胞表型恢复到初始表型,初步证明了该疗法能有效实现免疫重置。
鉴于目前已有几家公司开展了靶向CD19的CAR-T治疗SLE的研究,公司披露的另一项ELISPOT试验也在积极证明:与CD19单靶点CAR-T疗法相比,GC012F的CD19/BCMA双靶点设计,能更高效地清除产生自身抗体的B细胞和浆细胞。预计到2024年,我们可以看到更多相关数据。
优异的疗效与安全性,意味着GC012F正在血液肿瘤和自免领域不断解锁更大的获益潜力。
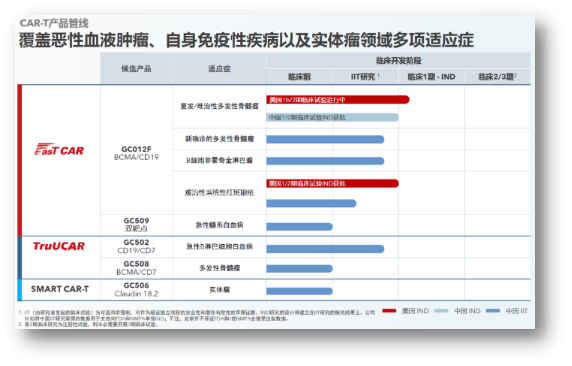
亘喜生物研发管线:覆盖血液瘤、实体瘤;双靶点、通用CAR-T多维度创新
除了GC012F之外,亘喜生物的研发管线还有多款独具特色的创新产品,包括针对实体瘤的Claudin18.2 CAR-T,以及CD19/CD7 CAR-T、BCMA/CD7 CAR-T两款通用CAR-T疗法。
FasTCAR:高Tscm比例保留,强化疗效
传统CAR-T在血液瘤方面已取得诸多突破,但疗效仍有提升空间,安全性更需持续改善,工艺复杂和高成本则限制了其可及性。正是基于这些问题,亘喜生物建立了独具特色的FasTCAR技术平台,将传统CAR-T的生产时间从几周缩短到次日完成,更快惠及患者的同时,也能显著降低人员及设备工时的成本,这对于后续降低定价,提升CAR-T可及性,意义重大。
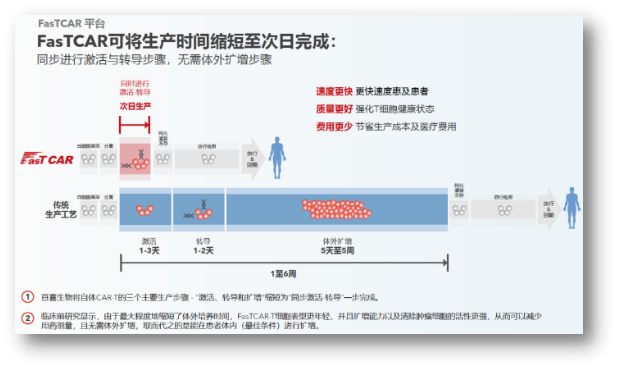
更重要的是,FasTCAR保留了高比例的年轻态Tscm细胞,细胞干性的增强显著改善了CAR-T的持久性,同时可以用更低的剂量达到更好的治疗效果。也是因为如此,提高疗效的同时也显著地改善了安全性。横向比较了下,GC012F的剂量水平一般都是105级别,相较于其他的一些疗法,普遍都是106级别的给药剂量。
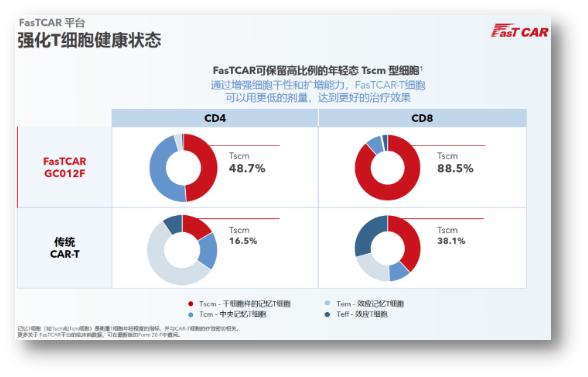
GC012F正是基于FasTCAR技术平台开发的核心产品,同时通过BCMA/CD19双靶点的结合,可以覆盖更多患者,并减少了逃逸复发风险。目前,GC012F在各项临床研究中已经治疗了60例患者,适应症涵盖RRMM、NDMM、B-NHL以及rSLE。随着后续其各适应症管线的临床数据不断更新,我们可以期待更多的临床证据将支持其差异化的疗效与安全性优势。
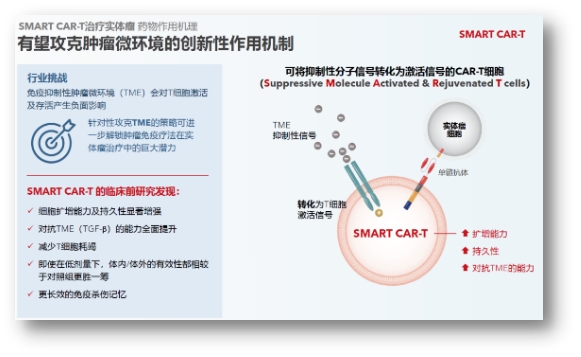
SMART CART:有望攻克实体瘤的创新技术
实体瘤一直是CAR-T疗法的难点,针对这一难题,亘喜生物开发了SMART CART增强型技术,作为“逻辑门开关”思路的一种方案,将抑制性分子信号转化为T细胞激活信号,从而更好且更久地对抗肿瘤微环境的免疫抑制性。
同样在上个月,亘喜在第38届SITC年会上首次公布了SMART CART管线产品GC506的临床前数据:对于由TGF-β介导的凋亡和耗竭的抵抗能力显著增强。在肿瘤细胞连续刺激模型中,即使面对TGF-β的抑制,SMART CART细胞相较于传统CAR-T细胞,在体外和体内都实现了更强劲且持久的特异性肿瘤细胞杀伤。
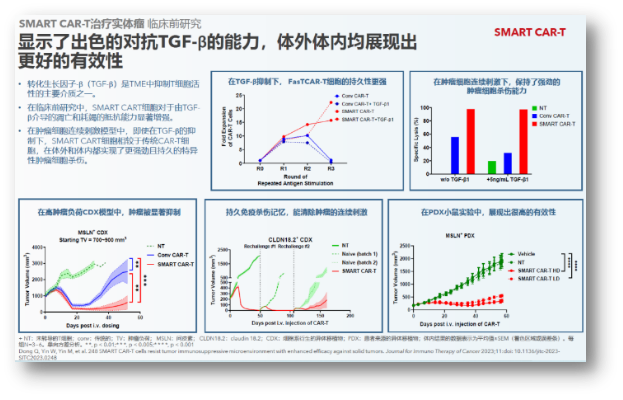
尤其是在小鼠模型中,与传统CAR-T细胞相比,SMART CART在肿瘤连续刺激实验以及高肿瘤负荷研究中,均显示出更优的肿瘤杀伤活性。小鼠模型注射后100天以上仍保持高度有效性,注射5个月后骨髓和脾脏的CAR-T细胞仍能杀伤肿瘤细胞,经刺激后仍可以再次扩增。

图片来自SITC官网摘要信息
TruUCAR:通用CAR-T
虽然自体CAR-T在血液瘤领域已经取得了很多突破性进展,但高成本,以及无法及时给药仍然很大程度上限制了临床上的广泛应用。因此,通用CAR-T是整个领域长久以来努力探索的重要方向。就亘喜而言,他们也建立了TruUCAR技术平台,通过多种设计来避免免疫排斥,并提高持久性。具体而言,通过表达CD7 CAR来靶向T细胞和NK细胞,避免HvG;通过T-Ag KO防止自相残杀,通过敲除TCR避免攻击正常细胞引发GvHD等。
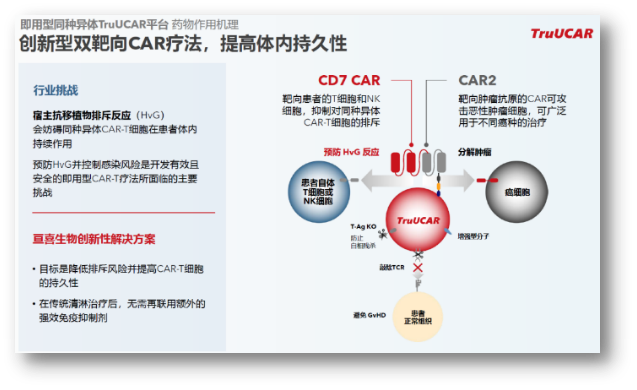
目前,GC502是基于TruUCAR技术平台开发的代表性产品,同时靶向CD19/CD7,初步临床研究表明在传统清淋后无需使用强效免疫抑制剂,目前4例患者治疗后3例达到MRD- CR/CRi,安全性方面同样具有“亘喜基因”:无4/5级CRS,无ICANS,无GvHD。初步表明TruUCAR的设计具有可行性,同时达到较理想的有效性与安全性。
喜获市场认可:逆势成长的亘喜,彰显价值空间
上周,亘喜生物还斩获了智通财经颁发的【最具投资价值中概股】一奖,也是唯二获此殊荣的Biotech。而在短短下半年里,亘喜已连续获得来自海内外投资界和行业界的6个奖项。特意去回溯了亘喜2023年的股价走势,在寒冬中,默默完成了100%+的逆势成长,且仍具备长期成长的投资空间。
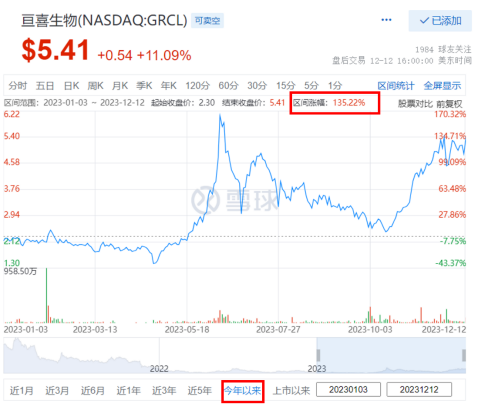
今年年中,Vivo Capital领衔一众知名医疗行业投资者通过私募配售的方式继续“加码”1.5亿美元。由此,亘喜生物不但得到了市场与业界的进一步看好,也让资金储备更加宽裕:根据财报显示,截至三季度末账上现金为2.34亿美元,将保障公司的研发与运营到2026年下半年。期待亘喜能继续专注于推进多条亮眼临床管线的后续开发。
总结
亘喜生物深耕CAR-T赛道,在生物学和技术实现方面付出了巨大努力,建立了独特的技术平台和差异化的研发管线。在传统CAR-T基础上通过提高Tscm比例、合理组合成熟靶点,并开创次日生产工艺等手段显著改善有效性和安全性,并为在多种血液肿瘤和自免疾病中的临床拓展提供了有利契机。在实体瘤CAR-T方面,通过设计独特的“抑制性信号转激活信号”逻辑门开关,全面强化了对抗肿瘤微环境的能力,提升了肿瘤杀伤活性和持久性。在通用CAR-T方面,通过巧妙的“CD7/肿瘤杀伤靶点”的双靶向设计,并结合TCR敲除,大大降低了免疫排斥、提升了疗效和安全性。在治疗领域方面,亘喜正不断解锁CAR-T疗法的应用场景:从后线到前线布局,从血液瘤到实体瘤,从癌症到自身免疫性疾病,多维度开拓,志存高远。近期,GC012F在SLE赛道上快速推进,达成关键的美国IND里程碑;而一线MM开发也获得令人惊艳的临床数据,可谓喜讯成双。坚持CAR-T的底层技术创新,并在此基础上搭建差异化研发管线,相信未来亘喜生物将取得更多的临床突破和出海里程碑。





