导语:不孕不育能遗传吗?这个问题看似是一个笑话,但事实上,许多不孕不育的发生都与遗传学因素有关,也有遗传给下一代的可能。随着基因测序技术的不断迭代升级,寻找不孕不育背后的致病基因正越来越多地支持不孕不育的临床诊断和治疗。近日,山东大学陈子江院士、秦莹莹教授团队与复旦大学金力院士、张峰教授团队合作揭示了关于早发性卵巢功能不全的遗传学病因。
致病性的判断:如何“推定”一个基因变异的“罪行”?
在过去十年中,随着高通量测序技术的出现,测序技术的飞速发展,临床实验室中用来检测遗传性疾病的方法也不断增加,包括括基因分型、单基因、基因包、外显子组、基因组、转录组和表观遗传学检测等。随之而来的一个重要问题,就是对测序所得的基因变异进行合理的解读,使之能够真正对临床的诊断和治疗提供指导。
在这样一个背景下,国际公认的医学遗传学和基因组学方面的权威机构美国遗传学与基因组学学会(American College of Medical Genetics and Genomics,ACMG)在2013年召集了一个由临床实验室主任和临床医生组成的工作组,以重新审视和修订基因变异解释的标准和指南,帮助众多临床机构和学术机构更加准确和规范地对遗传变异进行解读。
2015年,专家组的意见被正式发表在Nature子刊Genetics in Medicine上。2017年,在中国遗传学会遗传咨询分会主任委员、中国科学院院士贺林的主导下,多位遗传咨询领域专家共同编译了《ACMG遗传变异分类标准与指南》的中文版,推进了我国遗传咨询的标准化和规范化。
根据该《标准与指南》,对于一个变异,其致病性的从高到低共分成5个档位,即:(1)致病;(2)可能致病;(3)意义不明确;(4)可能良性;(5)良性。一个变异究竟会落在哪一个档位上,则需要根据现有的证据来判断,而这些证据的强弱也有一定的分级。
支持某个变异为致病性的证据可分为4档:(1)致病性,证据非常强(PVS);(2)致病性,证据强(PS);(3)致病性,证据中等(PM);(4)致病性,证据有支持性(PP)。
支持某个变异为良性的证据可分为2档:(1)良性,证据强(BS);(2)良性,证据有支持性(BP)。另外还有一类为独立证据(BA)。
举一些例子来说:
■ 如果已知某种基因失活是一种疾病发生的机制,而新发现的这个变异,是让该基因失活的变异,那么这可以算作该变异的一个PVS证据;
■ 如果通过计算机算法分析序列的保守性、进化上的情况、对RNA剪接的影响等方面,都认为该变异是无害,那么这可以算作改变异的一个BP证据……等等等等。
在得到了关于某变异的数个证据后,则可以根据ACMG推荐的判定规则,将变异进行分档,比如:一个PVS证据加两个PM证据,可以判定该变异是致病性的;一个BA证据加两个BS证据,可以判定该变异是良性的。
寻根溯源,测序手段确定早发性卵巢功能不全的遗传学因素
遗传缺陷、解剖异常、内分泌紊乱、免疫因素、全身性疾病及环境因素等都可能造成不孕不育。因此,明确病因对于不孕不育的临床诊疗具有重大意义。对于怀疑携带有遗传缺陷的不孕不育患者,遗传咨询和遗传检测有利于早诊断、早干预和定制个性化治疗策略。
卵巢早衰(Premature ovarian failure,POF)作为女性不孕的一大病因,很多情况下其背后也有遗传学因素在作祟。临床上为了提早诊断,已将卵巢早衰更名为早发性卵巢功能不全(Premature ovarian insufficiency,POI),而将POF定义为POI的终末阶段。POI指女性在40岁以前出现卵巢功能减退,主要表现为月经异常、促性腺激素水平升高、雌激素水平波动性下降。根据2019年的一项全球荟萃分析,其发病率约为3.7%。
染色体异常、拷贝数变异(CNV)和单碱基突变均有可能导致POI。10%~13%的POI患者携带染色体数目或结构异常,其中X染色体异常率高达94%。参与减数分裂、卵泡发育及卵母细胞成熟等过程的一些基因,其发生微重复或微缺失也与POF有关。一些生殖内分泌相关基因、卵泡发生相关基因、减数分裂和DNA损伤修复相关基因发生突变,以及导致以卵巢功能减退为临床特征之一的遗传性综合征的基因突变,则是目前已知的主要POI致病变异[4]。
然而,大部分POI病例是特发性的,目前已知的基因变异仅占患者的一小部分。先前的研究中,样本量以及对照组的不充分都阻碍了对新致病基因的识别。
为此,山东大学陈子江院士、秦莹莹教授团队与复旦大学金力院士、张峰教授团队紧密合作,基于国际最具规模的卵巢衰老队列和华表全外显子组测序(WES)数据库,绘制了POI致病变异遗传图谱,发现了20个新的卵巢衰老相关基因,将基因突变的病因贡献度由原来的15%提高至23.5%,为揭示卵巢生理性衰老机制及病理性衰老的干预提供方向和靶点。研究成果以“Landscape of Pathogenic Mutations in Premature Ovarian Insufficiency”为题发表于Nature Medicine。

图1 研究成果(图源:[5])
研究人员共招募了1790名POI患者,在排除了染色体异常和其他非遗传原因后,保留了1030名POI患者(包括120例原发性闭经和910例继发性闭经)进行全外显子组测序。结果发现,在已知的59个POI致病基因中,检测到了195个致病/可能致病变异,病例占比18.7%。
将POI队列与5000名健康的对照队列进行关联研究比较,确定了20个新的POI候选基因,这些基因更易因发生突变而失去功能,且在整个卵巢发育过程中参与性腺发生、减数分裂、卵泡发育、卵母细胞成熟和排卵等过程。
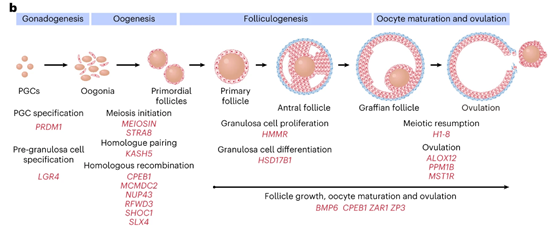
图2 新发现的致病基因参与卵巢发育过程(图源:[5])
将已知的59个POI致病基因与新发现的20个POI候选基因综合考虑后,共在23.5%(242/1030)的患者中检出254个致病/可能致病变异。另外,研究还证实了POI极高的遗传异质性。对比原发性闭经和继发性闭经,前者病例的遗传贡献度更高。多种遗传缺陷的积累导致更严重表型的可能性也被研究结果所支持。
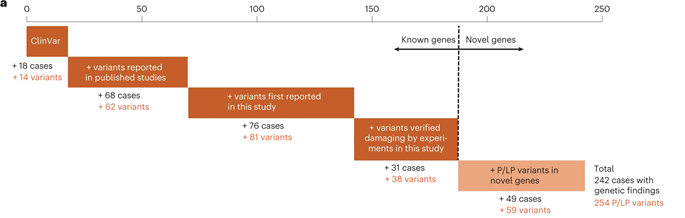
图3 依据不同程度证据确定的致病/可能致病变异在1030名POI患者中的贡献情况(图源:[5])
这一发现将促使临床上重新考虑对确诊患者进行常规突变筛查,一改当前POI管理指南基于单基因原因比较少见而给出的不推荐进行常规突变筛查的建议。若能实施常规临床WES,将促进患者病因的确定并指导其女性亲属也进行遗传咨询。尤其对于继发性闭经患者而言,在基因突变的警示作用下,能够在其POI发展的早期阶段及时通过计划生育、生育力保存或辅助生殖技术等手段干预,与病情“赛跑”。
本研究的通讯作者、复旦大学附属妇产科医院张锋教授表示,研究团队将在对基因分类的基础上,借助基因组大数据整合分析等人工智能手段,精准定位高风险人群,不断前移干预端口,让患者真正受益。另一方面,还将展开多中心的合作研究,不断扩充病例样本量和地域代表性,为中国人群绘制更全面的POI致病基因图谱。
参考资料:
[1]《ACMG遗传变异分类标准与指南》中文版正式发布,开启临床遗传咨询标准化时代
https://bio-x.sjtu.edu.cn/web/Show/294
[2]【陈巍学基因】视频34:判断基因变异的致病性
https://www.bilibili.com/video/BV1PJ411k7UH/
[3]王秋菊, 沈亦平, 陈少科, 等. 遗传变异分类标准与指南. 中国科学: 生命科学, 2017, 47: 668–688
[4]张倩, 颜军昊, 陈子江. 遗传因素不孕症的诊治策略 [J] . 中华妇产科杂志, 2021, 56(6) : 443-448. DOI: 10.3760/cma.j.cn112141-20201230-00922.
[5]Ke, H., Tang, S., Guo, T. et al. Landscape of pathogenic mutations in premature ovarian insufficiency. Nat Med (2023). https://doi.org/10.1038/s41591-022-02194-3
[6]追问|上海山东两地院士团队最新研究:揭秘卵巢衰老遗传密码
https://baijiahao.baidu.com/s?id=1757062726005138510&wfr=spider&for=pc





