导语:针对癌细胞在能量代谢中“谷氨酰胺成瘾”的特性,一种与谷氨酰胺结构高度类似的药物DON能够选择性地阻断多个谷氨酰胺参与的反应,“饿死”肿瘤细胞。在首批临床研究中,DON表现出良好的疗效,然而却因其对胃肠组织存在较高毒性而中止研究。现在,约翰霍普金斯大学的研究人员设计出一种DON的药物前体,能够只在癌细胞中激活起效,而在健康组织中被灭活。
古语“是药三分毒”辩证地说明了药物的疗效和副作用之间的复杂关系。就一般药物而言,在进入人体内后,通常只有极少一部分作用于病变部位,这既限制了药物的疗效,也带来了药物的毒副作用。而在药物研发的过程中,如果不能对不良反应的发生率有所限制,则意味着药物试验的失败。
尤其是在抗肿瘤药物领域,人们总是希望能药物够精准地杀死癌细胞而对正常的健康细胞无害。1913年,诺奖得主德国科学家Paul Ehrlich提出了一个“魔法子弹”(Magic Bullet)的概念,设想将细胞毒性药物选择性地输送到肿瘤部位。1958年澳大利亚药物化学发展权威Adrien Albert提出的“前体药物”(Prodrug)概念则是另一种解决思路,即让本身没有活性或活性很低的前体药物在体内代谢后再转变为有活性的药物,提高药物被吸收进入人体循环的速度与程度,提高靶向性,降低毒副作用。
癌细胞何以成为癌细胞
2000年,美国癌症学家Robert A. Weinberg教授和美国生物学家Douglas Hanahan教授在Cell上发表了第一版描述肿瘤细胞特征的综述“Hallmarks of Cancer”,至今被引用近4万次,堪称肿瘤领域的圣经。文中,他们提出了6个后天特征,分别是:
■ 自给自足的生长信号(Self-Sufficiency in Growth Signals)
■ 对抗生长信号的不敏感性(Insensitivity to Antigrowth Signals)
■ 逃避细胞凋亡(Evading apoptosis)
■ 无限复制(Limitless Replicative Potential)
■ 持续血管生成(Sustained Angiogenesis)
■ 组织侵袭转移(Tissue Invasion and Metastasis)。
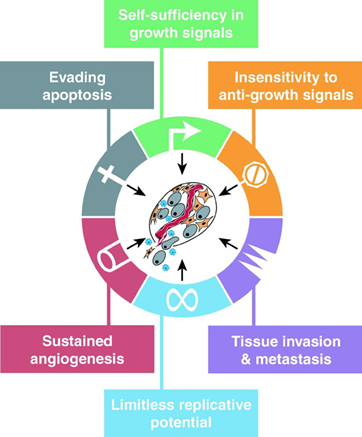
图1 肿瘤的后天特征(图源:[1])
2011年他们又在Cell发表了第二版“Hallmarks of cancer:next generation”,再度成为肿瘤领域的经典之作,引用次数高达6.3万多次。在第一版癌症特征的基础上,他们新增了四个特征:
■ 避免免疫摧毁(Avoiding Immune Destruction)
■ 促进肿瘤的炎症(Tumor-Promotion Inflammation)
■ 细胞能量代谢异常(Deregulating Cellular Energetics)
■ 基因组不稳定和突变(Genome Instability and Mutation)
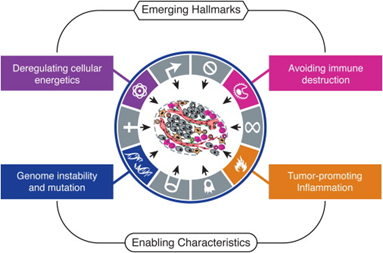
图2 肿瘤新发现的有利特征(图源:[2])
而肿瘤这10个异于正常细胞的特征,每一个都能成为治疗的靶点。
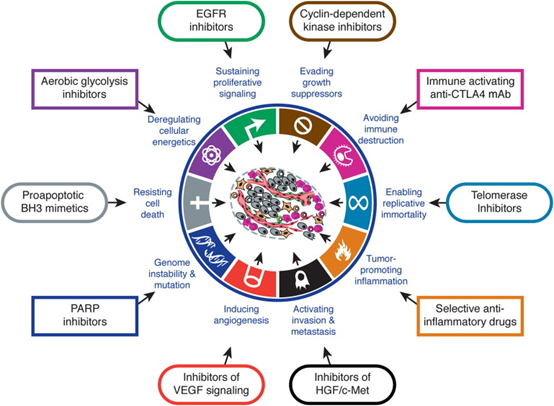
图3 靶向肿瘤特征的治疗(图源:[2])
今年1月,在Cancer Discovery上,Douglas Hanahan又发表了第三版“Hallmarks of Cancer:New Dimentions”,再次新增四个特征:
■ 解锁表型可塑性(Unlocking Phenotypic Plasticity)
■ 非突变表观遗传重编程(Nonmutational Epigenetic Reprogramming)
■ 多态微生物组(Polymorphic Microbiomes)
■ 衰老细胞(Senescent Cells)
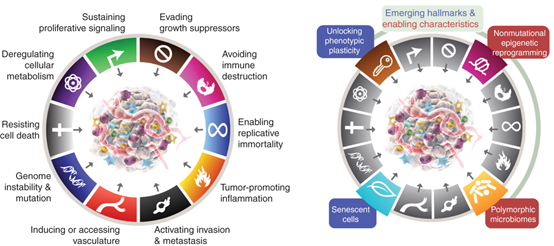
图4 新增4项癌症核心特征(图源:[3])
“欲罢不能”的谷氨酰胺
在肿瘤细胞的这些特征中,癌细胞异于正常细胞的代谢活动被称为“Warburg effect”,供能采用了正常细胞在无氧条件下才会使用的糖酵解途径,将葡萄糖“发酵”成乳酸。
为了维持正常的线粒体功能,癌细胞会通过回补过程依赖其他营养物质来满足三羧酸循环,合成肿瘤生长必需的脂质、蛋白和核酸。而谷氨酰胺是血浆中含量最丰富的游离氨基酸,成为增殖的癌细胞的能量主要来源。这种现象又被称为癌细胞的“谷氨酰胺成瘾”。另外还有证据表明,谷氨酰胺代谢对肿瘤细胞的侵袭也起到重要作用。
针对这一现象,科学家开始思考,如果切断肿瘤的谷氨酰胺来源,能否起到抗癌的作用。更令人振奋的是,多种类型的肿瘤都存在对谷氨酰胺的依赖性,这也就是说,针对这一机制开发出的药物将有望成为一种广谱抗癌药物。
“王者归来”的DON
DON就是这样一种从链霉菌中分离出来的谷氨酰胺类似物,可以对癌细胞中多种利用谷氨酰胺的酶起到抑制作用,使得癌细胞“饥饿而死”,同时还能增强T细胞在肿瘤微环境中的细胞毒性。DON已在小鼠和人类的试验中都证明具有抗癌功效,但可惜的是,某些快速更新的健康细胞,比如肠道内壁细胞,也会依赖谷氨酰胺。这使得DON在健康胃肠组织中也表现出毒性,引起粘膜炎、腹泻、胃出血等不良反应,最终被放弃临床开发。
为此,约翰霍普金斯大学的研究人员决定对DON进行化学修饰,给它添加上一些“前体基团”失去原有活性,使之摇身一变为肿瘤靶向前体药物DRP-104,而这些前体基团能被肿瘤内富含而肠道中不存在的酶所剪切掉,这样药物就能够更好地靶向癌细胞而免于对健康组织造成伤害。该研究结果以“Discovery of DRP-104, a tumor-targeted metabolic inhibitor prodrug”为题于2022年11月16日发表于Science Advances[4]。

图5 研究成果(图源:[4])
在小鼠试验中,研究人员发现,对比接受DON治疗和DRP-104治疗的肿瘤小鼠,后者肿瘤中活性药物剂量是胃肠道的11倍、血浆的6倍,这使得在全无胃肠道副作用的情形下完成了肿瘤的消退。此外,研究人员还发现,DRP-104能够以依赖CD8+T细胞的方式增强抗PD-1免疫疗法的疗效。不仅如此,经DRP-104单一疗法治愈的小鼠能够抵挡肿瘤的再次攻击,表明该方法能够建立起免疫记忆。在与该研究团队此前开发的另一种DON前体药物JHU-083的比较中,DRP-104的肿瘤靶向性也获得了优胜。
该研究的作者、约翰霍普金斯大学 药物发现项目主任Barbara Slusher 博士表示,类似的前体药物设计也有望应用于其他因毒性问题而未能通过临床试验的药物。同时,DRP-104凭借其在临床前试验中的优异表现,也已在美国各地进入I/II期临床试验阶段,未来将有望作为单一药物或与免疫疗法联合治疗晚期实体瘤。
参考资料:
[1]Hanahan D, Weinberg RA. The hallmarks of cancer. Cell. 2000 Jan 7;100(1):57-70. doi: 10.1016/s0092-8674(00)81683-9. PMID: 10647931.
[2]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4;144(5):646-74. doi: 10.1016/j.cell.2011.02.013. PMID: 21376230.
[3]Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022 Jan;12(1):31-46. doi: 10.1158/2159-8290.CD-21-1059. PMID: 35022204.
[4]Rais R, Lemberg KM, Tenora L, et al. Discovery of DRP-104, a tumor-targeted metabolic inhibitor prodrug. Sci Adv. 2022 Nov 18;8(46):eabq5925. doi: 10.1126/sciadv.abq5925. Epub 2022 Nov 16. PMID: 36383674.
[5]https://medicalxpress.com/news/2022-11-prodrug-cancer-cells-big-appetite.html





