导语:根据中国国家药品监督管理局(NMPA)官网显示,2021年度,我国共批准了约60款新药(不含新适应症、改良型新药、生物类似药、中药和疫苗),创造了近5年最高记录,其中有24款是全球首批新药。
在60款新药中,国产药品共26款,占比43%;进口共34款,占比57%;按照新药种类区分,小分子类新药共有39款,占比65%;生物药新药21款,占比35%;按适应症区分,抗肿瘤新药为26款,占比43%,非肿瘤新药占比57%。
24款全球首批新药(不包含疫苗和中药)在2021年获“官宣”批准上市,对比2020年的14款和2019年的16款,创下近3年来的历史新高。2021年我国24款创新药中,绝大多数都是通过优先审评、应急批准等加速通道获得批准上市,且具有一定临床意义。其中,不乏一批备受众人瞩目的药物,如首款国产ADC药物——维迪西妥单抗、两款CAR-T产品——赛注射液和瑞基仑赛注射液(表1)。
表1 24款2021年度全球首批新药
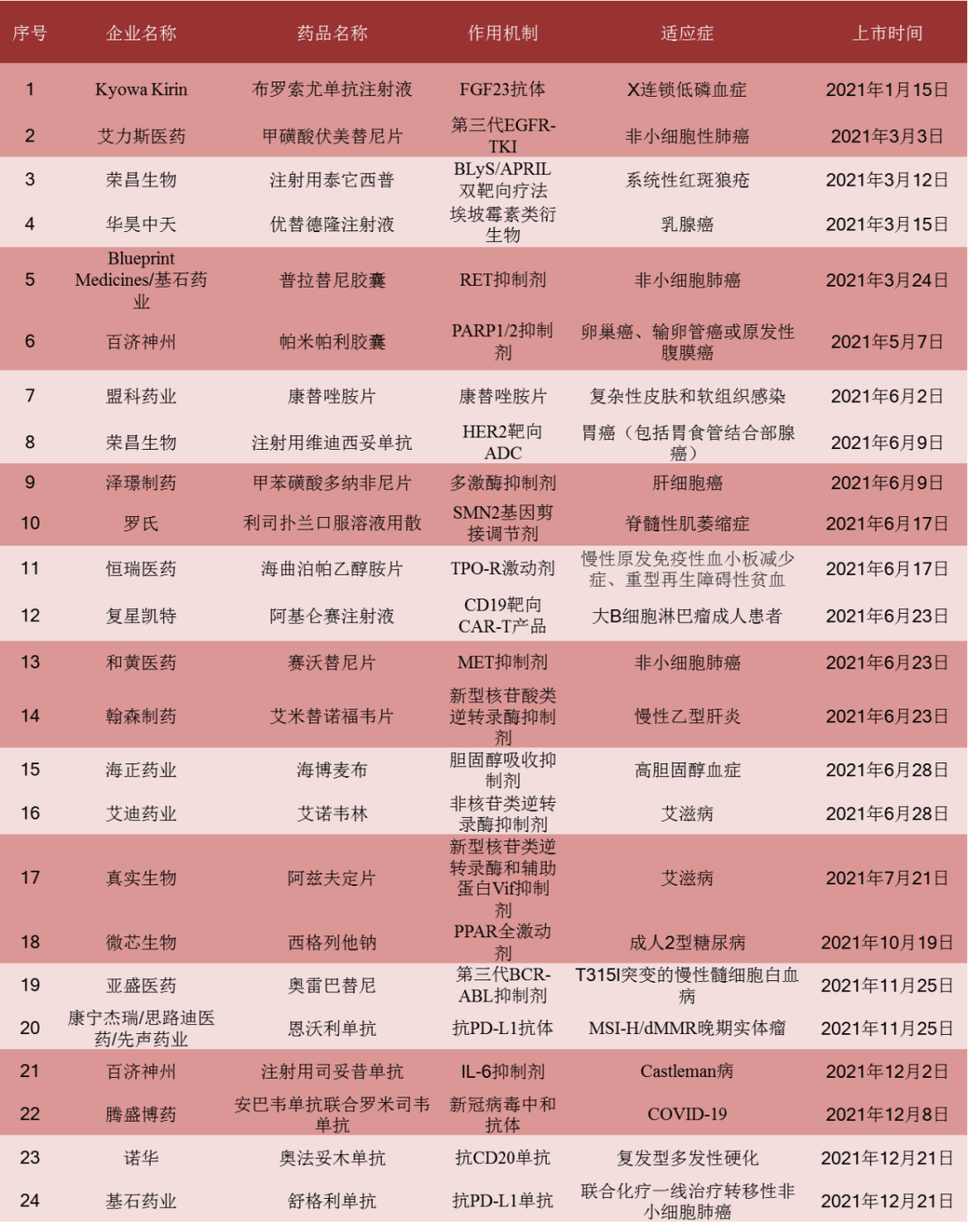
图片 信息来源:[1]丨制表:生物探索编辑团队
然而,研发的高光并不意味着商业化的成功,相反,创新药研发正在进入一种尴尬的局面,一边是不断推高的新药研发投入,另一边却是较为冰冷的商业化现实。对于2021年上市的24款首批新药,2021年度究竟表现如何?目前进展如何?让我们精选其中翘楚一探究竟。
一 艾力斯医药
药品:甲磺酸伏美替尼片
2021销售额:2.36亿
亮点:助力公司营收暴涨944倍!
2021年3月3日,艾力斯医药的1类新药、三代EGFR抑制剂伏美替尼获批上市,成为国产第二款获批的三代EGFR抑制剂,可用于治疗EGFR T790M突变阳性的局部晚期或转移性非小细胞性肺癌(NSCLC)成人患者。
根据艾力斯2021年度业绩快报公告,公司实现营业收入5.3亿元,同比增长94407.79%;归属于母公司所有者的净利润为1827.46万元,同比扭亏为盈;归属于母公司所有者的扣除非经常性损益的净利润为-6204.23万元,亏损大幅收窄。以上主要系报告期内公司产品甲磺酸伏美替尼片实现销售收入2.36亿元,以及确认伏美替尼海外授权交易的相关收入2.94亿元所致。
二 荣昌生物
药品:泰它西普
2021销售额:4730万元
药品:维迪西妥单抗
2021销售额:8400万元
亮点:两款创新药贡献营收大幅增长
3月29日,荣昌生物公布2021年财报,公司全年收入14.24亿元,同比增长高达468倍;净利润2.76亿元,净利润同比增长139.59%,研发投入7.11亿元。营收大幅度增长主要为企业产品上市首次实现盈利所贡献,其中泰它西普销售收入为4730万元,维迪西妥单抗为8400万元。
泰它西普于2021年3月获批,是荣昌生物自主研发的一款TACI-Fc融合蛋白,能同时抑制BLyS和APRIL两个细胞因子,具有全新的药物结构和双靶点作用机制,用于治疗系统性红斑狼疮、类风湿性关节炎等多种自身免疫疾病。维迪西妥单抗于2021年6月获批,为国产首款上市的ADC药物,目前该药已有转移性胃癌、尿路上皮癌两种适应症获批。医保支付标准分别为818.8元/支(规格80 mg)、3800元/支(规格60 mg)。
泰它西普的原发性干燥综合征(pSS)Ⅱ期临床研究取得了积极的结果,公司亦于2022年3月在美国启动了泰它西普治疗SLE的Ⅲ期研究,药物出海指日可待。纳入医保亦有望推动泰它西普的放量。从此次的营收状况来看,荣昌生物未来有望稳扎在科创板A股市场中。
三 复星凯特
药品:阿基仑赛注射液
亮点:120万的定价引发热议,商业化之路值得期待
2021年6月22日,复星凯特生物科技有限公司提交的阿基仑赛注射液的上市申请获NMPA批准上市,是国内第一个获批上市的CAR-T疗法,实现了CAR-T疗法零的突破。该注射液适应症为用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者。该药品市场零售价为120万元一针,价格高昂,需为癌症患者进行“量身定制”。
3月22日,复星医药披露2021年年报,公司去年实现营业收入390.05亿元,同比增长28.70%;净利润47.35亿元,同比增长29.28%。财报内未披露阿基仑赛注射液的具体销售情况,但公告称,截至2022年2月末,阿基仑赛注射液已列入23个省市的城市惠民保和超过40项商业保险,备案的治疗中心达75家,并已有约百名患者进入治疗流程。
阿基仑赛注射液于2021年实现全球销售额6.95亿美元,同比增长23.44%。目前,全球已有4款CD19 CAR-T细胞疗法获批上市,竞争趋于激烈,其中2021年登场的Breyanzi仅实现8700万美元的销售业绩,实属惨淡!对比前期的高额研发成本,阿基仑赛注射液能否成功实现商业化,我们拭目以待。
四 罗氏
药品:利司扑兰口服溶液用散
2021销售额(全球):6.59亿美元
亮点:作为SMA治疗药物的唯二选择,推动渤健降价入保
利司扑兰口服溶液用散(以下简称“利司扑兰”)由PTC Therapeutics、SMA基金会和罗氏联合开发,用于治疗2月龄及以上患者的脊髓性肌萎缩症(SMA)。2020年8月,该产品在美国上市,成为首个获批上市的靶向RNA的小分子。2021年6月17日,利司扑兰口服溶液用散正式获得NMPA批准上市。作为一款罕见病药物,利司扑兰的市场表现十分优秀,2021年全球销售额达到6.59亿美元。
目前,利司扑兰也是国内获批上市的SMA治疗药物的唯二选择,另一款为为渤健公司的鞘内注射药物诺西那生钠注射液。利司扑兰的获批上市给渤健大幅降价入保带来巨大的推动力。2021年,渤健的谈判代表现身谈判现场,国家医保局谈判代表张劲妮在与渤健代表谈判时直言,“每一个小群体都不应该被放弃”。经过八轮谈判,诺西那生钠注射液最终以低于3.3万元每针的价格被成功纳入医保目录,降价后患者首年6针的治疗费用将降至20万元左右,以70%~80%的报销额度计算,患者只需自付4~6万元。此后,患者每年只需注射3次,每年医保报销前的治疗费用进一步减至10万元左右。
截至目前,利司扑兰已在包括中国在内的超过40个国家及地区获批,全球已有超过3000位SMA患者接受利司扑兰治疗。中华医学会儿科分会罕见病学组组长、复旦大学附属儿科医院主任医师王艺教授表示,“利司扑兰的获批,意味着SMA的治疗进入了口服治疗的新阶段。”
五 康宁杰瑞/思路迪医药/先声药业
药品:恩沃利单抗
2021销售额:440万元
亮点:具备差异化优势,布局多个中国高发瘤种
2021年11月25日,康宁杰瑞制药旗下的PD-L1皮下注射抑制剂恩沃利单抗获批上市。恩沃利单抗是先声药业、思路迪与康宁杰瑞三方战略合作的全球唯一可通过皮下给药的PD-L1单域抗体药物,也是中国原研的首个PD-L1抗体,已获批用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗。
恩沃利单抗200 mg/支定价为5980元,每周一次皮下给药,每疗程使用4支,每疗程药费23920元;2021年12月8日,恩沃利单抗的首批处方落地。根据公司财报显示,截至2021年12月31日,公司实现销售收入1.46亿元,其中恩沃利单抗在短短20多天内实现销售收入440万元。
目前,肿瘤免疫治疗已经成为临床肿瘤治疗方案中的主流药物之一,国内国外也有多款产品已经上市,但患者依然存在重大未被满足的临床需求,对临床上更好的药物充满渴求。创新的分子设计使得恩沃利单抗在有效性、安全性、便利性、依从性方面具有差异化的优势。除已上市适应症外,恩维达还在多个中国高发瘤种中进行了布局,包括肺癌、胆管癌、肝细胞癌、结直肠癌、妇科肿瘤,以及泛瘤肿等具有未满足临床需求的领域进行了相应的临床研究。
六 腾盛博药
药品:安巴韦单抗联合罗米司韦单抗
亮点:中国首个新冠治疗特效药
2021年12月8日,新冠单克隆中和抗体安巴韦单抗联合罗米司韦单抗联合疗法获NMPA批准上市,用于治疗轻型和普通型且伴有进展为重型(包括住院或死亡)高风险因素的成人和青少年(12—17岁,体重≥40 kg)新冠患者。该药品由清华大学医学院教授、清华大学全球健康与传染病研究中心与艾滋病综合研究中心主任张林琦教授领衔研发,此次获批标志着中国拥有了首个全自主研发抗新冠病毒特效药。张林琦表示,该特效药可以提供治疗和预防作用,一针能持续9个月甚至1年。
七 百济神州
药品:帕米帕利胶囊
亮点:中国原研一类新药PARP抑制剂
2021年5月7日,据NMPA官网,百济神州产品帕米帕利胶囊(产品名:百汇泽®)获NMPA批准上市,用于既往经过二线及以上化疗的伴有胚系BRCA突变的复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗,百汇泽®着眼于铂敏感和铂耐药复发性卵巢癌的治疗研究,作为目前已知唯一一款非药物泵(P-gp)底物的PARP抑制剂,低耐药带来了潜在更长的无进展生存期,延缓复发。
百汇泽®于2021年获纳入国家医保目录,今年初起正式执行。进入医保后的百汇泽®价格从每盒(60粒,规格20 mg)7000元降至3216元,降幅达54%。2022年2月25日,公司公告披露2021年度业绩,2021营业总收入为75.89亿元,和上年同期相比增加257.9%,帕米帕利胶囊的具体销售额暂未披露。
八 翰森制药
药品:艾米替诺福韦片
亮点:首个中国原创口服抗乙肝病毒创新药
2021年6月23日,翰森制药自主研发的首个中国原创口服抗乙肝病毒创新药艾米替诺福韦片也获批上市,用于慢性乙型肝炎成人患者的治疗,于2021年底被纳入国家医保目录。2022年4月,翰森制药发布2021年报,报告期内公司实现收入99.35亿元,同比增长14.33%;公司创新药销售收入42.02亿元,同比增长168.9%,占营业收入的42.3%;公司研发投入17.97亿元,同比增长43.5%,占营业收入的18.1%。肿瘤业务方面,2021年收入达到54.81亿元,比上年增长了近15亿元,占总营收比例超过55%。
翰森制药共有超过25个创新药进入临床阶段,即将进入密集收获期。其中在研新药中有5款创新药处于II期及以上临床阶段,包括已报产的有望成为首个国产长效EPO药物的培莫沙肽。
九 盟科药业
药品:康替唑胺片
亮点:新版目录中唯一具有新化学结构的抗耐药菌新药
2021年6月1日,康替唑胺片正式获得国家药品监督管理局(NMPA)的批准,用于治疗复杂性皮肤和软组织感染,成为首个在我国上市的国产噁唑烷酮类抗菌新药。获批仅半年,康替唑胺片即被纳入国家医保目录体现了国家对创新药的支持与鼓励。2021年11月,盟科药业申请科创板上市已获受理。2021年12月,盟科药业宣布,由公司自主研发的新一代噁唑烷酮类抗菌药康替唑胺片(优喜泰)通过国家医保谈判,被纳入医保,是此次新版目录中唯一的具有新化学结构的抗耐药菌新药。
十 泽璟制药
药品:甲苯磺酸多纳非尼片
亮点:新型多激酶抑制剂类小分子抗肿瘤药物
甲苯磺酸多纳非尼片(以下简称“多纳非尼”)是泽璟制药开发的口服多靶点、多激酶抑制剂类小分子抗肿瘤药物,属于1类新药,公司拥有独立的自主知识产权。多纳非尼于2021年6月获得NMPA批准。近日,泽璟制药在投资者互动平台表示,公司首款1类新药多纳非尼已上市并进入医保,公司商业运营团队正在积极推进多纳非尼医院准入工作。在短短3个月左右,已经准入了200多家医院,公司销售工作正保持积极推进。
十一 诺华
药品:奥法妥木单抗
亮点:多发性硬化治疗领域突破性创新药物
2021年12月21日,国家药监局发布公告,通过优先审评审批程序批准罕见病治疗药品奥法妥木单抗注射液的进口注册申请,用于治疗成人复发型多发性硬化,包括临床孤立综合征、复发缓解型多发性硬化和活动性继发进展型多发性硬化。奥法妥木单抗注射液是一种抗人CD20的全人源免疫球蛋白G1单克隆抗体,靶向CD20分子,通过诱导B细胞溶解达到治疗作用。该品种的上市为患者提供了治疗选择。今年3月24日,奥法妥木单抗在中国开出首张处方,这标志着全球多发性硬化治疗领域突破性创新药物正式落地中国。
十二 恒瑞医药
药品:海曲泊帕乙醇胺片
亮点:小分子TPO-R药物市场前景广阔
2021年6月19日,恒瑞(600276.SH)1类新药「海曲泊帕乙醇胺片」获批上市,用于因血小板减少和临床条件导致出血风险增加的既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症成人患者,以及对免疫抑制治疗疗效不佳的重型再生障碍性贫血成人患者。
2022年1月11日,恒瑞医药公布,公司收到美国FDA关于同意海曲泊帕乙醇胺片进行临床试验的函,将于近期开展III期临床试验。公司宣称该药品相关项目累计已投入研发费用约2.131亿元。
十三 和黄医药
药品:赛沃替尼片
亮点:首款获批的选择性MET抑制剂
2021年6月,赛沃替尼获NMPA附条件批准,用于治疗接受全身性治疗后疾病进展或无法接受化疗的MET外显子14跳跃突变的非小细胞肺癌患者。目前,赛沃替尼正作为单药疗法或与其他药物的联合疗法,开发用于治疗包括肺癌、肾癌和胃癌在内的多种肿瘤类型。自此,中国迎来了首款获批的选择性MET抑制剂,赛沃替尼成为和黄继呋喹替尼、索凡替尼之后第3款上市的抗癌新药。
第一代MET抑制剂的开发受肾毒性困扰,因其代谢产物溶解度差而在肾脏中结晶导致肾脏损伤。和黄医药针对该问题,研发了无肾毒性的赛沃替尼,最终成功上市。赛沃替尼与cMET的IC50为5nM,对MET Y1268T有强效活性,对其他突变体则活性较弱,赛沃替尼具有很好的激酶选择性。该药品一盒200mg*21片规格,售价约为8588元/盒。
十四 海正药业
药品:海博麦布片
亮点:海正药业获批的首个创新药
2021年6月28日,海正药业获得NMPA颁发的《药品注册证书》,正式获批生产,这也是海正药业获批的首个创新药。海博麦布片是海正药业研发的1类降脂药,用于治疗原发性高胆固醇血症,其作用机制是通过作用于小肠刷状缘转运蛋白NPC1LI抑制食物和肠肝循环胆固醇吸收。
国家1类新药是指在药品注册分类中属于第一个类别的药品,其中,化学药品1类是指境内外均未上市的创新药品,因此国家1类新药具有非常高的创新性,代表了我国药品注册分类中药物创新的最高水平。简言之,海博麦布片不仅是世界上首创发明的一种全新药物,而且疗效显著。截至获批前,海正药业在该产品上的研发投入已高达2.89亿元。
十五 艾迪药业
药品:艾诺韦林
亮点:抗艾滋病领域国家1类新药
2021年6月28日,国家药监局发布公告,江苏艾迪药业股份有限公司申报的1类创新药艾诺韦林片通过优先审评审批程序,获批上市。该药用于与核苷类抗逆转录病毒药物联合使用,治疗成人HIV-1感染初治患者。2021年12月3日,艾迪药业晚间公告,公司抗艾滋病领域国家1类新药艾诺韦林通过了医保谈判,首次被纳入国家医保目录。
创新,是整个生物医药行业面临的必选项。与此同时,生物医药的创新需要高技术、高投入,这也意味着整个行业机会与风险并存。创新药的长周期、高投入决定了高定价的必然性。然而,高定价把很大一部分经济条件有限的患者拦在了门外,由此导致创新药通过国家谈判进入医保越来越受关注。如何解决支付问题,几乎成为国产创新药能否在国内实现商业化落地的一大关键。
题图来源:Innoplexus,仅用于学术交流。
撰文|露娜
排版|文竞择
参考资料:
[1]https://www.allist.com.cn/
[2]http://www.remegen.cn/
[3]http://www.fosunkitebio.com/
[4]https://www.roche.com.cn/
[5]https://www.beigene.com/
[6]创新高!2021年中国国家药监局“官宣”批准这24款新药
[7]百济神州公布2021年第四季度和全年财务业绩
[8]翰森制药:2021年实现营业收入99.35亿元
[9]https://www.zelgen.com/gongsijianjie/





