一般意义上的创新药是指具有自主知识产权专利的药物。相对于仿制药,创新药物强调化学结构新颖或新的治疗用途,在以前的研究文献或专利中,均未见报道。
创新药首先从实验室发现新的分子或化合物开始,经过动物实验了解其安全性及毒性反应,了解在动物体内的代谢过程、作用部位和作用效果,再经过首次人体试验,经历I期、II期、III期临床试验,证实安全有效及质量可控制之后,才可以获得药物监管机构的批准。创新药可能先后经历10到15年的时间,耗资可达数十亿美元。
本文的创新药不是指一般意义的创新药,主要是指化学药的首仿药、强仿药,中药的新药及引进的国外药品(尚未在中国审批和销售),因为在中国药企现阶段去谈论一般意义的创新药没有实际意义。
当然,如果药企研发能力比较高,同时又有强大的资金实力做后盾的话,可以进行真正意义上的创新药研发。
(一)化学药的首仿药
首仿药是指“首先研究申报国外已上市而在国内未上市的药品”。在我国,首仿药有着很强的竞争优势。
发改委公开征求意见的新版《药品价格管理办法(征求意见稿)》提出,通过定价和审批制度相结合来调控仿制药过热现象,具体包括:对在专利药品保护期结束后国内前三个仿制上市的药品,首仿药可在统一定价上浮30%基础内进行单独定价,二仿和三仿药定价则可为首仿药价格的90%和81%。
按照上述意见稿,前三个仿制上市药品可享受定价优待。今后或拟对二仿药和三仿药各批两家,加上一家首仿药企业,意味着未来可享受区别或单独定价待遇的仿制药企将达五家。
享受区别或单独定价待遇的仿制药企达五家,这给中国的仿制药企业注入了一剂强心针,也就是说,抢不到首仿,起码在5个排名内,还是有很大的机会获得较好的市场利益。
北京鼎臣医药管理咨询中心专家认为,这几年是国际专利药密集到期的时间段,对仿制药大国中国来说,可谓盛宴,同时,也是中国仿制药更新换代的年代,这对中国的消费者来说也是一件好事。
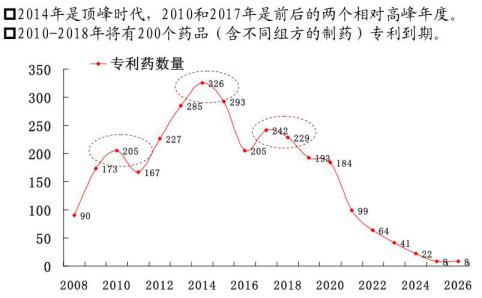
图1 已经到期或即将到期的专利药分布
如图1所示,2014年到2026年,将近有2000个专利药物到期,可谓空前绝后。
北京鼎臣医药管理咨询中心专家认为,首仿药业已成为中国药物创新的重要领域。首仿药申请数量激增是国食药监总局新药申请快速增长的最主要因素。恒瑞、华海、科伦、正大天晴等传统研发强队依旧是首仿药领先的第一梯队,癌症、心脑血管等大病领域及单抗药物依旧是首仿药主要阵地。
而且,治疗不同疾病的到期专利药数量有较大差异。中国药企如果进行首仿,就要明确自己的疾病领域发展方向,因为不同疾病领域的专利到期药品的数量是不等的。
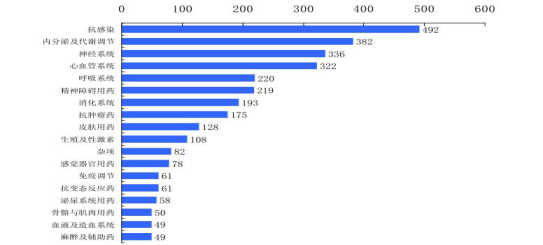
图2 专利药治疗领域专利药到期数量分布
(二)化学药强仿药
很多中国药企目前竟然不知道国家有强仿的制度规定。中国知识产权局在2012年就颁布了《专利实施强制许可办法》(第64号),明确规定了可以对专利药在一定条件下进行强仿,并于2012年5月1日起施行。
而且在世界贸易组织的《与贸易有关知识产权协议》框架下,强制许可是合法认可的方法,用以保障发展中国家的人民突破价格等方面的壁垒,确保获得可负担的急需药物。
中国疾病预防控制中心首席专家邵一鸣建议中国的药物强仿分三类推进:A类为重大传染病的治疗药物,必须强仿。B类为治疗恶性肿瘤、癌症等影响生命却不是扩散性疾病的药物,可以强仿为主,与国外药企合作生产,大幅降低药价。C类为治疗糖尿病、心脏病、心脑血管疾病等常见病、多发病的药物,可以将强仿作为一种谈判手段。
国内第一批进行强仿企业的产品,如恒瑞的奥沙利柏、多西他赛,恩华医药的齐拉西酮,海南海药的紫杉醇注射液,信立泰的泰嘉等,都很成功。
强仿是获得首仿权的最快途径,然而强仿、首仿并不这么简单,因为这是对原研产品专利技术的挑战。在获得与原研品市场决战权利之前,必然需要应对来自原研厂家的各类反击。
多西他赛原研厂家是赛诺菲公司,在恒瑞多西他赛仿制品注册申请之时,赛诺菲就开始提出各种专利保护和诉讼要求。在近10年诉讼拉锯期间,因各方提供证据而各有胜败,直至2008年恒瑞医药才获得最终胜利。
(三)中药新药
按照国家《药品注册管理办法》的规定 ,中药新药注册分为9类:
(1)未在国内上市销售的,从植物、动物、矿物等物质中提取的有效成分及其制剂。
(2)新发现的药材及其制剂。
(3)新的中药材代用品。
(4)药材新的药用部位及其制剂。
(5)未在国内上市销售的,从植物、动物、矿物等物质中提取的有效部位及其制剂。
(6)未在国内上市销售的中药、天然药物复方制剂。
(7)改变国内已上市销售中药、天然药物给药途径的制剂。
(8)改变国内已上市销售中药、天然药物剂型的制剂。
(9)已有国家标准的中药、天然药物。
《药品注册管理办法》其实给了药企一个非常宽泛的中药新药研发领域,也就是说,任何可能性都可以存在。
北京鼎臣医药管理咨询中心专家认为,中国药企进行中药研发首先要立足国内市场,根据中国疾病的种类、慢性病的种类和药企自身的优势进行中药新药研发。
需要明确的是,中药研发不要仅仅盯着药品,保健品也是研发范围之内的主要品种。未来消费者会在中药健康干预领域有更多的需求,这种需求可不仅仅指中药产品。
鼎臣咨询医药战略规划专家认为,未来中药研发的竞争会加剧,因为化学药研发高昂的成本、漫长的研发时间和极高的研发失败风险,会让很多跨国企业投入大量的研发精力从天然植物中寻找有活性的先导化合物,以及试图与前沿生物技术相结合而寻找出新的活性化合物。
对中医药的研究,不能再重复过去跟踪式仿效的西药研发模式,而是应该在中医药理论指导下,创新思路,运用中医药理论去深入分析人体的生理、病理现象及药物对它们的作用和影响,还要研究人体对药物的作用和影响,否则会导致低水平重复研发和申报的情形出现。
鼎臣咨询医药战略规划专家建议,中药的研发要注意结合和引进最新生命科学研究的新进展、新技术。这些新进展、新技术包括现代生命科学、基因组学、信息学、系统论等学科,在中医药理论指导下去进行分析、研究,然后针对所研究疾病的各个不同阶段的具体情况,做出富有创新性的符合中医药理论和实践的实验研究设计,才能有创造性的发现。
本文作者:史立臣, 来源:“鼎臣咨询”微信公众号,转载请注明作者及出处。