本文转自医药魔方数据微信,发布已获医药魔方授权,如需转载,请与医药魔方联系。
全球知名医药信息情报服务商Informa旗下的Biomedtracker和Meddevicetacker本月初联合发布了《2016年Q4展望报告》,对今年第4季度即将发生的24项重大医药研发事件进行了盘点,并根据药物的分类、适应症以及所在临床试验阶段,分析了某药物在对应临床阶段的成功率以及整体FDA获批成功率。
1、阿尔茨海默氏症药物Solanezumab
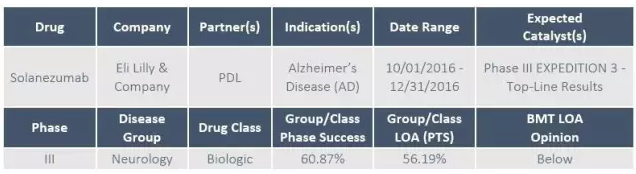
礼来计划第四季度公布其治疗轻度阿尔茨海默病药物Solanezumab的EXPEDITION-3研究的一线数据。Solanezumab是一种单克隆抗体,理论上能够结合可溶性单体形式的β淀粉样蛋白,使其在聚集形成淀粉样斑块之前从大脑中清除。
2012年公布的III期EXPEDITION-1和EXPEDITION-2研究结果显示,solanezumab 未能改善轻至中度阿尔茨海默病患者的认知和功能,未到达研究的主要终点。但是二次亚组分析结果又显示,solanezumab对减缓轻度阿尔茨海默病患者认知能力的下降具有统计学意义。
EXPEDITION-3 研究于2013年7月启动,招募了约2100例轻度阿尔茨海默病患者。如果此次公布的临床数据能再次确证之前在特定患者亚组中的分析结果,淀粉样蛋白假说将得到有力支撑,并支持对阿尔茨海默病患者进行早期干预。礼来近期已启动一项代号为EXPEDITION-PRO的Solanezumab治疗前驱阿尔茨海默病的 III 期研究。
2、晚期膀胱癌疗法Opdivo
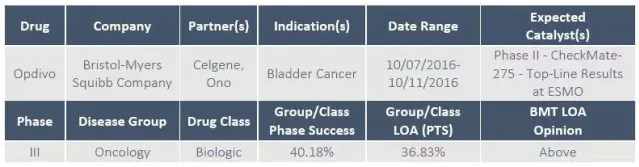
Opdivo是一种可以与T细胞上的PD-1蛋白结合的PD-1抗体,能够阻断PD-1和PD-L1及PD-L2的结合。该免疫肿瘤疗法早已被批准用于治疗多个实体瘤及血液系统恶性肿瘤。
2016年6月,基于II期 CheckMate-275 研究的结果及其它支持性数据,FDA授予Opdivo治疗含铂化疗期间或化疗后疾病进展的不可切除性的局部晚期或转移性尿路上皮癌(mUC)突破性药物资格。
CheckMate-275是一项II期、开放标签、单臂研究, 旨在评估Opdivo在含铂化疗期间或化疗后病情进展的不可切除性局部晚期或转移性尿路上皮癌患者中的安全性与有效性。 CheckMate-275研究的主要终点包括客观缓解率,及其它有效性指标包括缓解持续时间和总体生存率等。 CheckMate-275汇总数据将在2016年10月上旬的欧洲临床肿瘤学会年会(ESMO)上展示。新公布的数据无疑会对支持该疗法报批FDA有重大影响。该疗法已在9月向欧洲药品管理局(EMA)递交用于这一适应症的申请。
3、社区获得性肺炎药物Solithera
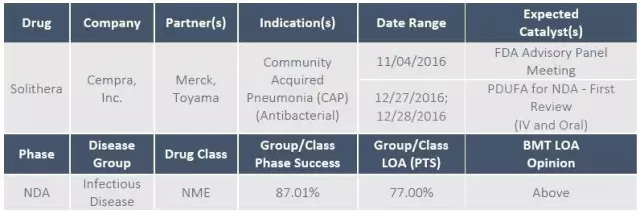
今年第4季度对Cempra公司至关重要。社区获得性肺炎药物Solithromycin的命运将在12月27日和28日揭晓。在做出决定前,FDA咨询委员会将在11月4日对其上市资料进行讨论。
第一代和第二代大环内酯抗生素只能在单一位点上与细菌核糖体结合。Solithromycin是新一代高效大环内酯类抗生素,能与细菌核糖体在三个位点产生键和,因此可与大多数已对大环内酯产生耐药的社区获得性肺炎病原体产生反应。Solithromycin是自阿奇霉素以后,第一个有望实现口服与注射双重给药的抗生素,同时又比阿奇霉素和克拉霉素具有更强的抗菌活性。
Cempra 提交的solithromycin的两项研究(口服给药,从注射给药过渡到口服给药)均在早期临床应答率上达到非劣效终点。虽然部分通过注射给药的患者出现了注射部位疼痛和皮疹的不良反应(发生率34.3%,拜尔莫西沙星只有13.1%),引发了一定担忧,但鉴于病情严重的患者对于注射型抗生素的急切需求,这应该不会成为solithromycin上市的阻碍因素。如果FDA咨询委员会没有对solithromycin的安全性提出质疑,并给予肯定推荐,solithromycin有望成为2017年上市的重磅抗生素药物。
4、克罗恩病药物RHB-104
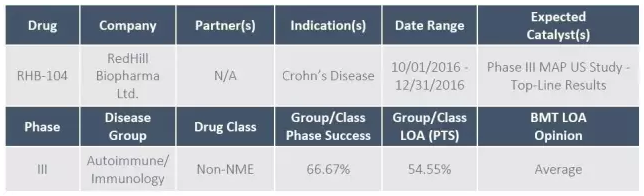
RHB-104是 RedHill 公司最核心的在研药物,开发用于治疗中重度活动性克罗恩病和多发性硬化症,预计在今年第4季度公布III期MAP US 研究的一线中期结果。
RHB-104是由利福平+克拉霉素+氯法齐明组成的三合一复方胶囊制剂,用于治疗副结核分支杆菌感染,后者被认为是克罗恩病的疾病激发因素。
RHB-104已经被FDA授予了治疗儿科克罗恩病的孤儿药资格,已经开展了多项初期研究,包括PK研究、I期安全性研究、食物效应研究、药物相互作用研究等。一项群体药动学研究也已经启动。
RedHill近日宣布,计划招募270例患者的随机、双盲,安慰剂对照 MAP US研究已经入组了大约200例患者。RedHill目前正在考虑对III期试验的方案进行调整,以更好地评估RHB-104的治疗效果,收集更多的内镜下黏膜治愈率数据等。但并不会修改26周缓解率这一主要研究终点。
5、乙肝治疗药物替诺福韦艾拉酚胺
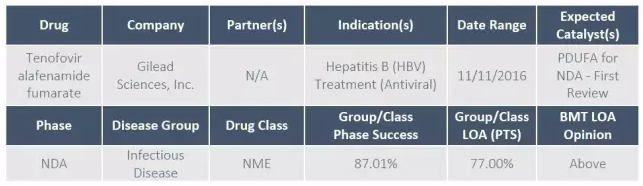
吉利德在2016年1月11日向FDA提交了TAF治疗乙肝的NDA,PDUFA预定审批期限是2016年11月11日。TAF向欧盟提交的上市申请也在等待CHMP的审批,预计在2016年11月-2017年2月获得结果。
TAF是替诺福韦的前药,可以实现在淋巴组织有较高的血液浓度,同时血浆药物浓度水平较低。
NDA的提交是基于两项为期48周的随机、双盲、III期研究的结果,与Viread相比,TAF在初治或接受过治疗的HBeAG阴性和HBeAg阳性慢性乙肝患者中到达了非劣效终点。在肾功能和骨骼安全新方面,TAF都优于Viread。接受TAF治疗的患者,在第48周时,髋关节和脊柱骨密度水平较基线的下降值都明显低于Viread。
鉴于篇幅所限,其余14个重大新药不再展开详细介绍。感兴趣的朋友,可通过微信消息留下邮箱,有工作人员将原文报告发送给您。