Claude R. Mallet, Dimple D. Shah
Waters Corporation, Milford, MA, U.S.
简介
在 1938 年,美国政府通过了联邦食品、药物和化妆品法令( FFDCA , FDCA ,或 FDA ),赋予美国食品和药品监督管理局( FDA )督察食品、药品和化妆品的权利。如今,美国 FDA 管理着除了美国农业部管理的肉类、家禽肉和某些奶制品之外的国内和进口的所有食品。现在,所有的牛奶都要由 FDA 、美国政府和牛奶生产商共同努力监控药物残留。在 2007 年的财政年报 1 中,有超过 400 万的样品都要分析广大范围的抗生素,如内酰胺、大环内酯和四环素。例如,美国 FDA 建议牛奶中某种大环内酯类抗生素替米考星的最大残留量( MRL ) 50ug/kg ,这个标准也被欧盟接受。许多国家都遵从美国食品和农业联合组织 / 世界卫生组织( WHO )的 40 μ g/kg 的最大残留量,而不是为每种药物设置各自的最大残留量。
大环内酯类是一组药物,它的活性来源于大环内酯环的存在,而大环内酯环上有可能有一个或多个脱氧糖,经常为二脱氧甲基已糖和脱氧糖胺。内酯经常是 14- 、 15- 或 16- 环的。大环内酯类抗生素被广泛应用于兽医药物,以治疗许多疾病,例如哺乳期奶牛的呼吸道疾病、临床症状不显的乳腺炎,或者它们可以被作为饲料添加剂以促进生长。如果牛奶提取期太短,抗生素残留可能仍然存在,可对消费者带来直接的毒副作用(过敏反应) 2 。
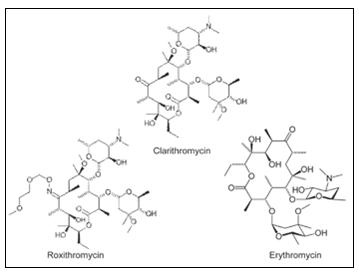
图 1 大环内酯类抗生素
离线的 SPE 萃取方案
传统上,微生物检测 3 被用来监测食品基质中的抗生素。这些方案都有很好的定量结果,但越来越缺乏高度的专属性。随着现代实验室 LC/MS 或 LC/MS/MS 系统的普遍使用,多残留方法是更被常规工作所认可的方法。
包含食品基质的分析方案通常是很复杂的,需要数个小时的手动操作。例如,饮用水方案(较低的样品复杂度)由下列步骤组成:直接上样到 SPE 小柱、少量的清洗步骤、洗脱,以及最后的蒸干和用流动相复溶。象食品样品之类的固体基质(较高的样品复杂度)必须先用水溶液或有机提取缓冲液均质提取,然后是一些离心步骤、液液萃取(可选项),最后在实施 SPE 萃取方案前用水溶液稀释。关于牛奶分析,最常用的萃取方案是用乙腈沉淀蛋白 4 。混合物然后离心数分钟。上清液可以用其它的萃取技术进一步提纯。
离线的 SPE 牛奶方案
步骤 1 : 加入 5mL 的牛奶到 50-mL 的离心管中
步骤 2 : 加入 15mL 的乙腈
步骤 3 : 涡旋并在 3200RPM 转速下离心 15min
步骤 4 : 转移上清液到 50-mL 的离心管中
步骤 5 : 加入 20mL 的正己烷
步骤 6 : 涡旋 15min
步骤 7 : 在 3200RPM 转速下离心 15min
步骤 8 : 移去正己烷层
步骤 9 : 蒸发乙腈 / 牛奶上清液到 3mL
步骤 10 : 加入 15mL 0.1M 、 PH 为 8.0 的硫酸盐缓冲液
步骤 11 : 用 10mL 的甲醇活化 Oasis® HLB ( 6cc )
步骤 12 : 用 10mL 的水活化 Oasis® HLB ( 6cc )
步骤 13 : 用 10mL2% 的 NaCl 活化 Oasis® HLB ( 6cc )
步骤 14 : 用 2mL 0.1M 、 PH 值为 8.0 的磷酸盐活化 Oasis®HLB ( 6cc )
步骤 15 : 上载复溶的样品(步骤 10 )
步骤 16 : 用 5mL 的水清洗
步骤 17 : 用 5mL40% 的甲醇水溶液清洗
步骤 18 : 使 Oasis HLB 流干 5min
步骤 19 : 用 5mL95% 的甲醇水溶液洗脱
步骤 20 : 蒸发近干( 45min )
步骤 21 : 用 1mL 的初始条件流动相复溶
步骤 22 : 用 0.45 μ m 的聚偏二乙烯氟化物( PVDF )过滤萃取物
在线的 SPE 萃取方案
以前的出版物(在线 SPE/LC/MS/MS 部分Ⅰ、Ⅱ和Ⅲ)介绍了新颖的自动化萃取 / 分析技术: Waters AquaAnalysis 系统。总体解决平台带来了多种好处:减少手工操作、减少溶剂消耗和减少样品体积。使用在线的 SPE/LC/MS/MS 技术平台省去了消耗时间的蒸干 / 复溶步骤。
在线的 SPE/LC/MS/MS 技术不仅仅适合于饮用水分析。饮用水样品可直接上样到自动进样器,然后就是完全自动化的电脑控制的萃取 / 分析步骤。对于食品分析,固体样品要先转变成液体形式。分析开始于均质化以释放被束缚的分析物到液相萃取缓冲液。均质化需要经过离心步骤,然后上清液被转移出来。在这时,目标分析物以合适的形式存在,以便于其它的净化、浓缩或萃取步骤,例如,液液提取( LLE )和 SPE 。通过使用软件控制下的在线 SPE 方案,食品样品的萃取 / 分析过程现在仅需要均质化、离心和稀释步骤。
在线的 SPE 牛奶方案
步骤 1 : 加入 1mL 牛奶到 50mL 的离心管中
步骤 2 : 加入 20ul 一定浓度的氨水
步骤 3 : 加入 2ml 的乙腈( 2:1 的比例)
步骤 4 : 涡旋并在 3500RPM 的转速下离心 15min
步骤 5 : 转移 2mL 的上清液到 20ml 的进样瓶
步骤 6 : 加入 18mL 的水
步骤 7 : 进样 5mL
实验
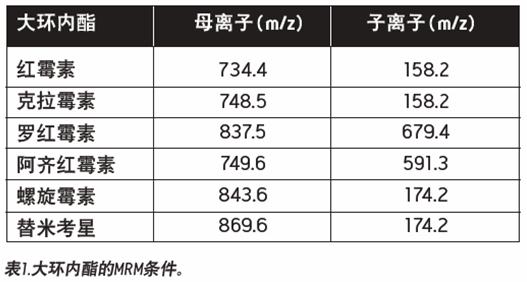
大环内酯所用的 MRM 条件都列在了表 1 中。使用的 SPE 萃取柱是 Waters® Oasia HLB 2.1x 20 mm , 25 μ m ,中性 pH 值上样,流动相(无添加物 ) )。使用的分析柱是 XBridgeTMC18 2.1x 50 mm 3.5 μ m ,低 pH 值流动相洗脱。清洗和再活化参数都列在了下面。
SPE 和 LC 工作条件
载样泵: 管路 A:100% 水
管路 B : 100% 甲醇
载样流速: 4.0 mL/min
清洗液: 20% 的甲醇 / 乙腈( 30/70 ) +0.5% 甲酸
再平衡泵: A : 50/50 的甲醇 / 丙酮
B : 80/20 的乙酸乙酯 / 丙酮
C : 80/20 的正己烷 / 丙酮
再平衡流速: 4.0 mL/min
萃取柱: Oasis HLB 2.1x 2 mm , 25.0 μ m
分析柱: XBridge C18 2.1x 50 mm , 3.5 μ m
结果和讨论
图 2 为添加了 0.5ppb 每种抗生素的牛奶样品的具有代表性的提取离子色谱图。抗生素在微量水平都具有良好的信号和峰形。对于食品样品,样品的复杂度要高于饮用水样品,而且清洗步骤需要优化以最大程度的清除干扰物质,而不洗脱掉所感兴趣的分析物。图 3 为添加了 100ppb 红霉素,分别用 5% 、 10% 、 20% 、 30% 和 40% 甲醇清洗的色谱图。在图 2 中, 20% 甲醇清洗与 5% 甲醇清洗相比,会产生更高的信号。 5% 甲醇的弱信号可归因于离子抑制效应。可是,当清洗步骤中的有机相比例增加的过多时,信号的灵敏度由于部分洗脱而有下降趋势。
图 4 为红霉素浓度从 1.0ppb 到 500.0ppb 、线性系数为 0.9902 的校正曲线图。表 2 是在线和离线 SPE 萃取方案肩并肩的对比,从文献到处理天然的牛奶样品到适于 LC/MS 或 GC/MS 分析的理想形态。当评价在线 SPE/LC/MS/MS 和离线方案时,通常的萃取程序和溶剂、实验室人员和时间的整体应用都是很重要的。其它的食品样品有各种各样的结构,在 SPE 萃取前可能需要其它的处理程序。例如,牛奶样品在用 SPE 装置进一步净化前需要简单的蛋白沉淀和离心。对于像
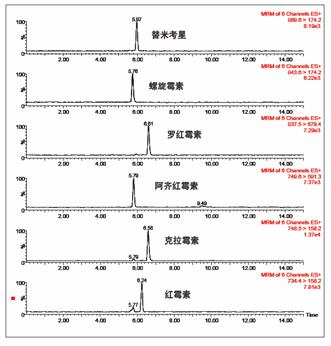
图 2 添加了 0.5ppb 的牛奶的提取离子色谱图

图 3 牛奶提取的优化清洗
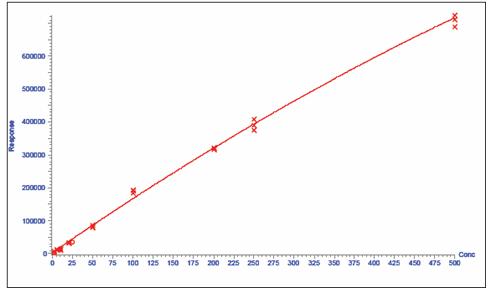
图 4 红霉素的校正曲线
水果和蔬菜这样的固体样品,使用萃取缓冲液的低温碾磨或均质化步骤是优先考虑的方法。对于通常的萃取程序,很容易找到每个萃取步骤都使用广大范围的体积和时间的文献报道。通常,使用 SPE 方案,上样、清洗和洗脱体积都根据 SPE 装置的床台尺寸估量。这可以首先保证在每个步骤中 SP E 吸附剂的整体润湿。一旦这个数值定下来,这可以增加数倍 ( 依赖于化合物 ) 确保多个体积置换以使清洗步骤最小化清除干扰和洗脱步骤最大化回收率。在实际的操作中,柱床上样量诱捕能力的增加需要 SPE 程序中体积的增加;这最终会增加样品制备时间和溶剂消耗量。
结论
在过去的这些年里,许多国家已经尽了很大努力来进一步提高他们的国内和进口的食品供应的安全性,以使消费者能够享受安全的食品供应。正因为这样,许多分析方法都可以得到,并在常规的分析中被使用。随着最小化溶剂使用量和最大化实验室人员使用的需求增
加,自动化平台的使用绝对会满足这些要求。这篇应用文献描述了牛奶样品中抗生素的自动化萃取和分析。传统的萃取前处理步骤是极其消耗时间的;他们需要更大数量的化学品和各种各样的试剂。使用 Waters AquaAnalysis 系统处理牛奶样品的时间大约为 20min ,这与离线方案相比可以减少 70-90% 的时间。
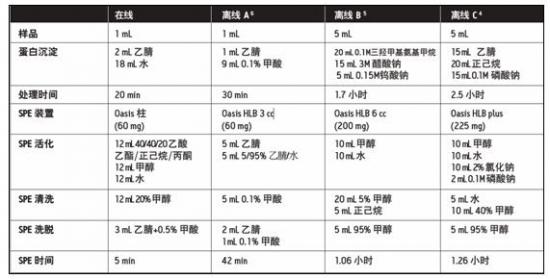
表 2 牛奶样品的离线和在线萃取方案的溶剂消耗量和处理时间
参考文献
[1] U.S. FDA National Milk Drug Residue Database. Food and Drug Administration, Center for Food Safety and Drug Administration, 2007.
Available online:  https://www.cfsan.fda.gov/~ear/p-mis.html
https://www.cfsan.fda.gov/~ear/p-mis.html
[2] W A Moats, M B Medina. Veterinary Drug Residues, ACS Symposium Series 636, American Chemical Society, Washington, DC, 1996, p.5.
[3] 43rd Meeting of the Joint FAO/WHO Expert Committee on Food Additives. Evaluation of Certain Veterinary Drug Residues in Food, WHO Tech. Rep Ser., No 855, 1995, p.85.
[4] J Wang, D Leung, S P Lenz. J. Agric. Food Chem. 54: 2873, 2006.|
[5] M Dubois, D Fluchard, E Sior, P H Delahaut. J. Chromatogr. B.753: 189, 2001.
[6] S B Turnipseed, W C Andersen, C M Karbiwnyk, M R Madson, K E Miller. Rapid Commun. Mass Spectrom. 22: 1467, 2008.
来源:沃特世科技(上海)有限公司
联系电话:电话: (021)68795888,4008202676(免费电话支持专线)
E-mail:lin_hai_zhang@waters.com