【目的和要求】
1. 掌握聚丙烯酰胺凝胶电泳的基本原理
2. 掌握垂直板状凝胶电泳槽的使用和凝胶的配制方法。
3. 学会利用相对迁移率分析蛋白质种类。
【实验原理】
带电颗粒在电场的作用下,向着与其相反的电极移动,称为电泳。
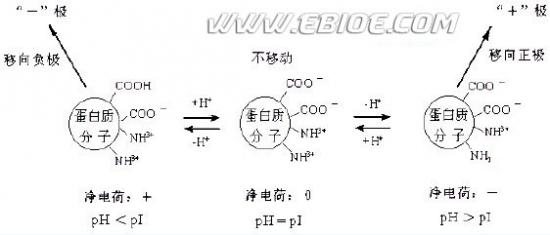
电泳做为一种物质分离及鉴定技术,其原理在于任一物质质点,由于其本身的解离作用或由于表面上吸附有其它带电质点,在电场中便会向一定的电极移动。蛋白质是两性电解质,在一定的pH条件下,就会解离而带电,带电的性质和多少取决于蛋白质分子的性质和溶液的pH值和离子强度。处于pI的蛋白质分子所带的电荷为零,在电场中不移动。若pH<pI,蛋白质分子带正电荷,在电场中向负极移动,pH>pI的情况正好相反。
目前所采用的电泳方法大致可分为三类:显微电泳,自由界面电泳及区带电泳。以区带电泳应用比较广泛,区带电泳按其支持物的物理性状,可以分为四大类:(1)滤纸电泳及薄膜电泳(如醋酸纤维素薄膜电泳);(2)粉末电泳:如纤维素粉、淀粉电泳等;(3)细丝电泳:如尼龙丝、人造丝电泳;(4)凝胶电泳:如聚丙烯酰胺和琼脂糖凝胶电泳。
聚丙烯酰胺凝胶,是由丙烯酰胺单体(Acr)和少量的交联剂N,Nˊ-甲叉双丙烯酰胺(Bis)在催化剂(过硫酸胺或核黄素)和加速剂(N, N,NˊNˊ-四甲基乙二胺)的作用下聚合交联成的三维网状结构的凝胶。以此凝胶为支持物的电泳称聚丙烯酰胺凝胶电泳(PAGE)。具有机械性能好、化学性能稳定、灵敏度好、分辨率高的优点。PAGE应用十分广泛,可用于蛋白质、酶、核酸等生物分子的分离、定性、定量和少量制备,还可测定分子量和等电点等。
PAGE根据其有无浓缩效应,分为连续系统和不连续系统两大类。前者电泳体系中缓冲液pH及凝胶浓度相同,带电颗粒在电场中的泳动主要靠电荷和分子筛效应;后者电泳体系中缓冲液离子成分、pH、凝胶浓度及电位梯度是不连续的,带电颗粒在电场中的泳动不仅主要靠电荷和分子筛效应,还有浓缩效应。
(1)凝胶对样品分子的筛选效应(分子筛效应)
电场中,颗粒小、呈球形的样品分子泳动速度快;颗粒大、形状不规则的分子通过凝胶空洞时受到的阻力大,泳动慢。
(2)不连续系统对样品的浓缩效应
凝胶层的不连续性:不连续系统的凝胶包括浓缩胶和分离胶。浓缩胶的孔径大,分离胶的孔径小。在电场的作用下,蛋白质颗粒在大孔胶中泳动时遇到的阻力小,移动快。而在小孔胶中泳动时遇到的阻力大,移动慢。因此,在两层凝胶的交界处,由于凝胶孔径的不连续性使样品迁移受阻而压缩成很窄的区带。
缓冲液离子成分和pH的不连续性:在两层凝胶中均有Tris和HCl。Tris的作用是维持溶液的电中性及pH。HCl在一定pH条件下易解离出Cl- ,它在电场中迁移率大,走在最前面,故称为快离子或前导离子。电极缓冲液中的甘氨酸在pH8.3的缓冲液中解离度很小,仅为0.1-1%,因而在电场中迁移率很小,称为慢离子或尾随离子。血清中,大多数蛋白质pI在5.0左右,在 pH8.3或6.7时均带负电荷,在电场中均移向正极,其有效迁移率介于快慢离子之间,于是蛋白质就在快慢离子间形成的界面处,被浓缩成极窄的区带。当进入pH8.9的分离胶时,甘氨酸解离度增加,其有效迁移率超过蛋白质,因此氯离子和甘氨酸离子沿着离子界面继续前进。蛋白质分子由于分子量大,被留在后面,然后分离成多个区带。
此外,电泳体系中电位梯度的不连续性对样品的浓缩和迁移也具有一定作用。
(3)电荷效应
在分离胶中,各种血清蛋白所带静电荷不同,而有不同的迁移率。表面电荷多,则迁移快,反之则慢。
因此各种蛋白质按照电荷多少、分子量大小及分子形状以一定顺序排成一个个区带。不连续PAGE所具有的分子筛效应、浓缩效应和电荷效应大大提高了它的分辨率。
电泳后蛋白质染色目前常用的是考马斯亮蓝法,其比氨基黑染色法灵敏度高,可以进行定量扫描,比银染法简便。
本次实验是利用聚丙烯酰胺凝胶电泳法来分离各种血清蛋白。血清中含有前清蛋白、清蛋白、α-球蛋白、β- 球蛋白、γ- 球蛋白和各种脂蛋白等。各种蛋白质由于分子量、等电点及形状不同,在电场中的泳动速度不同。
【实验试剂和器材】
(一)试剂
1. 制备分离胶、浓缩胶有关试剂
(1)凝胶贮液:在通风橱中,称取丙烯酰胺30g,甲叉双丙烯酰胺0.8g,加重蒸水溶解后,定容到100ml。过滤后置棕色瓶中,4℃保存,一般可放置1个月。
(2)pH8.9分离胶缓冲液: Tris 36.3g ,加1mol/L HCl 48ml,加重蒸水80ml使其溶解,调pH8.9,定容至100ml, 4℃保存。
(3)pH6.7浓缩胶缓冲液: Tris 5.98g ,加1mol/L HCl 48ml,加重蒸水80ml使其溶解,调pH6.7,定容至100ml, 4℃保存。
(4) TEMED(四乙基乙二胺)原液
(5)10%过硫酸铵(用重蒸水新鲜配制)
2. pH8.3 Tris-甘氨酸电极缓冲液
称取 Tris 6.0g,甘氨酸28.8g,加蒸馏水约900ml,调pH8.3后,用蒸馏水定容至1000ml。置4℃保存,临用前稀释10倍。
3. 50% (v/v)甘油
4. 1% (w/v) 溴酚蓝:称取100mg溴酚蓝,加蒸馏水10ml,搅拌直到完全溶解,过滤除去聚合的染料。
5. 5× 样品缓冲液(loading buffer):10ml
3.1ml 1mol/L Tris-HCl (pH6.7) 312.5mmol/L
5ml 50% (v/v)甘油 25%
0.5ml 1% (w/v) 溴酚蓝 0.05%
1.4ml 蒸馏水
4. 考马斯亮蓝G250染色液:称100mg考马斯亮蓝G250,溶于200ml蒸馏水中,慢慢加入7.5ml 70%的过氯酸,最后补足水到250ml,搅拌1小时,小孔滤纸过滤。
6. 1%琼脂
7. 鸡血清
(二)器材
电泳仪、垂直板电泳槽,微量加样器、长针头注射器、烧杯、试管、滴管、平皿等。
【实验方法】
(一)电泳装置的安装
夹心式垂直平板电泳槽两侧为有机玻璃制成的电极槽,两个电极槽之间夹有一个凝胶模。该模有一个U形硅胶框,长与短玻璃板及样品槽模板(梳子)组成。电泳槽由上贮槽(白金电极在上)、下贮槽(白金电极在下)和回纹状冷凝管组成。两个电极槽与凝胶模间靠螺丝固定。各部件依下列次序组装:
1. 上贮槽上装上螺钉,仰放在桌上。2. 将长、短玻璃板分别插到U形硅胶框的凹形槽中。玻璃板应干净、干燥,注意勿用手接触灌胶的一面。
3. 将已插好玻璃板的凝胶模平放在上贮槽上,短玻璃板应面对上贮槽。
4. 将下贮槽的销孔对准已装好螺钉的上贮槽,双手以对角线的方式旋紧螺丝。
5. 竖直电泳槽,在长玻璃板下端与硅胶模框交界处的缝隙内用滴管假如已熔化的1%琼脂。目的是封住空隙,凝固后琼脂中应避免有气泡。
(二)制胶
1. 在小烧杯里按下表配好分离胶(充分混匀,但不能带入太多的空气)
将配好的分离胶沿着高玻璃一边缓缓地倒入玻璃板之间,约10cm高,倒好后,电泳槽垂直放好,用长针头注射器吸取1~2ml dH2O,针头平口一边贴着玻璃慢慢地在胶面上封上一层水,这时胶与水交界面处能看到一条清晰的界面,后逐渐消失。置30~40分钟后,又出现清晰的界面,用长针头注射器小心吸出水,用滤纸吸干剩余的水分。
2. 在小烧杯里按下表配好浓缩胶(充分混匀)
将小烧杯中的浓缩胶沿着高玻璃一边缓缓地倒入玻璃板中已凝聚好的分离胶上,直到离玻璃板顶端5~10mm时,插入梳子,约15~20分钟,待胶凝固后,小心地取出梳子,即可见多个样品槽。
(三)点样
1. 用大烧杯取适量电极缓冲液加到电泳槽中,电极缓冲液应盖住矮玻璃。接上电源,电压调到50V,用加样枪取10~30μl样品加到样品槽中。
2. 将电压调到100V,等到溴酚蓝走过浓缩胶后,将电压调到150V,待溴酚蓝离底部0.5cm时(约3小时),切断电源。
(四)剥胶、染色、脱色
松开四个螺丝,取出夹胶的玻璃板并置水中,轻轻地将玻璃板与胶分离。用刀切下浓缩胶,分离胶放入盛有染色液的大平皿中,1小时后,将染色液倒入回收瓶中,将胶用水洗几次,加入脱色液,放到脱色摇床上进行脱色,一段时间后看结果。
(五)结果判断
脱色后的凝胶上一般可清楚呈现若干区带,分别为前清蛋白、清蛋白、球蛋白(多条),可将它们各自的位置判断出来。
(六)制备凝胶干板
常用凝胶真空器制备干板。若无此仪器,可将脱色后的胶板浸泡在保存液中3~4小时。然后,在大培养皿内平放一块干净玻璃板(13x13cm),倒少许保存液,在玻璃板上均匀涂开,取一张预先在蒸馏水中浸透的玻璃纸,平铺在玻璃板上,赶走气泡,小心取出凝胶平铺在玻璃纸上,赶走气泡。再取一张浸泡过的玻璃纸覆盖在凝胶上,赶走气泡,将四边多余的玻璃纸紧紧贴于玻璃板的背面。平放于桌上自然干燥1-2天,即可得到平整、透明的干胶板,可长期保存不褪色,便于定向扫描。
【注意事项】
1. 制备凝胶应选用高纯度试剂,否则会影响凝胶聚合与电泳效果。
2. 若硅橡胶条、玻璃板不光滑洁净,在电泳时会造成凝胶板与玻璃板或硅橡胶条剥离,产生气泡或滑胶;剥胶时凝胶板易断裂。为防止此现象,所用器材均应严格地清洗。硅橡胶条、梳子可用“洗涤灵”清洗。玻璃板需用重铬酸钾洗液浸泡3-4小时,或0.2mol/LKOH的酒精溶液中20分钟以上,用清水冲洗,再用 “洗涤灵”刷洗,最后用蒸馏水冲洗,用乙醇冲洗后阴干。
3. 电泳装置安装时,各部件位置要适当,旋紧螺丝时应均匀用力,以免缓冲液渗漏。
4. 用琼脂封底及灌凝胶时不能有气泡,以免电泳时影响电流通过。
5. 凝胶完全聚合后,必须放置30~60分钟,使其充分“老化”后,才能轻轻取出梳子,切勿破坏加样槽底部的平整,以免电泳后区带扭曲。