本文转载自“药智精英俱乐部”。
12月4日,国家药监局发布文章称,国家药品监督管理局批准艾美赛珠单抗注射液(英文名:Emicizumab Injection)进口注册申请,用于治疗存在凝血因子Ⅷ抑制物的A型血友病患者。
据药智药品注册与受理数据库,该药为罗氏申请的进口药品,于2017年12月获得CDE承办。艾美赛珠单抗注射液作为临床急需品种,在2018年1月30日,以“儿童用药品,罕见病”为由纳入优先审评程序第二十六批,加快审评审批。鉴于该药临床疗效明确,风险可控,耐受性良好,给药便利依从性好,在不同种族患者之间未见明确疗效及安全性差异,11月30日,国家药品监督管理局批准了本品进口注册,用于存在凝血因子Ⅷ抑制物的A型血友病患者(先天性凝血因子Ⅷ缺乏)的常规预防性治疗以防止出血或降低出血发生的频率。
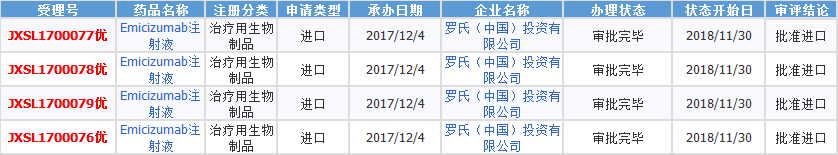
数据来源:药智药品注册与受理数据库
国家药品监督管理局还明确将按照中共中央、国务院对深化药品审评审批制度改革的有关精神,继续加快境外已上市新药在我国进口注册的速度,对治疗罕见病的药品和防治严重危及生命疾病的部分药品优化审评程序,简化上市要求,确保我国患者早日用上境外已上市新药。
A型血友病是由于X染色体连锁的凝血因子Ⅷ缺乏、凝血功能异常引起的隐性遗传性出血性疾病。患者血液不能正常凝固,易出现不受控和频繁的持续或自发性出血。艾美赛珠单抗注射液由罗氏公司研发,是一种重组人源化、双特异性单克隆抗体,可代替活化凝血因子Ⅷ的辅因子活性,促进FⅨa对FⅩ的活化,进而导致凝血酶的生成显著增加,使FⅧ功能障碍或完全缺乏FⅧ的A型血友病患者的出血部位达到止血。







