本文转载自” 药明康德”

对于医药公司来说,尤其是初创型生物技术研发公司,一个药物的开发是否达到关键里程碑,往往决定着整个公司的未来。最近三家生物技术公司的在研新药有望在最近迎来关键里程碑,其中包括FDA对杜氏肌营养不良症罕见病药物的上市决定,也包括一款阿兹海默病新药的3期临床数据揭晓。这几款新药的临床研发进展让我们先睹为快。
新药名称:Ataluren(Translarna™)
针对疾病:无义突变导致的杜氏肌营养不良症(nmDMD)
研发公司:PTC Therapeutics
临床进展:欧盟批准
关键日期:9月28日,FDA决议

新药简介:
Ataluren是一种新型口服给药的小分子化合物,用于治疗由于无义突变引起的遗传疾病。Ataluren正在临床开发用于治疗由无义突变(nmDMD)引起的杜氏肌营养不良症。无义突变涉及多种遗传疾病,在mRNA中包含的遗传密码的翻译中产生过早停止信号,阻止了全长功能蛋白的产生。Ataluren与核糖体相互作用,以使核糖体越过mRNA上的过早的停止信号,并允许细胞产生全长的功能蛋白。
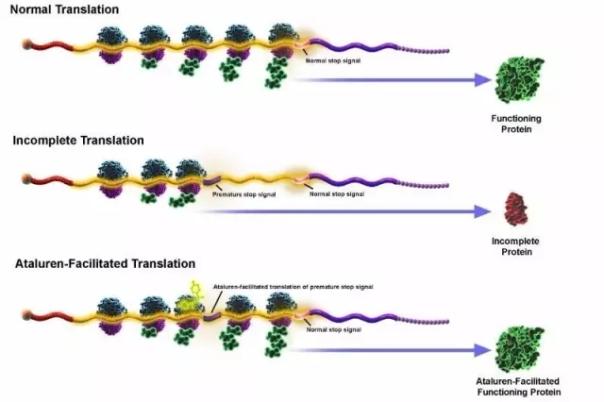
▲Ataluren作用原理(图片来源:PTC公司官网)
Ataluren在欧盟(EU)成员国,冰岛,列支敦士登,挪威,以色列和韩国以商标名称Translarna™获得批准,用于治疗五岁及以上有活动能力患者的nmDMD。欧洲药品管理局(EMA)已经将该药物指定为孤儿药物。FDA曾以疗效不显著为由拒绝批准Ataluren,但将在9月28日重新讨论该药物的上市申请。
新药名称:Intepirdine
针对疾病:阿兹海默病
研发公司:Axovant Sciences
临床进展:3期(Intepirdine与多奈哌齐联用)
关键日期:近期公布3期临床结果

新药简介:
Intepirdine是口服给药的5-HT6受体小分子拮抗剂。阻断5-HT6受体能够促进脑中乙酰胆碱的释放。Intepirdine通过促进乙酰胆碱在脑内的释放直接增加其浓度。胆碱酯酶抑制剂多奈哌齐通过防止乙酰胆碱分解来增加乙酰胆碱水平。当两种药物联合使用时,它们通过互补机制进一步增加乙酰胆碱的浓度,而不会增加通常与胆碱酯酶抑制剂相关的副作用,例如恶心和呕吐。
▲Intepirdine结构式(图片来源:维基百科)
这项3期临床研究MINDSET是一项多中心、随机、双盲、安慰剂对照的研究,旨在评估intepirdine治疗中度阿兹海默病患者的安全性、耐受性和有效性。 intepirdine正在研究作为多奈哌齐超过24周的附加疗法。该试验是在稳定的多奈哌齐治疗背景下(多奈哌齐用药超过24周后),比较一次口服剂量的intepirdine相对安慰剂组的疗效,在1,315例轻度至中度阿兹海默病患者中进行。主要功效评估使用阿兹海默病评估量表-认知子量表(ADAS-Cog)和日常生活量表(ADCS-ADL)。根据Clinicaltrials.gov的数据,这项研究将在2017年10月完成数据收集并给出初步结果。
新药名称:GS-0976
针对疾病:非酒精性脂肪肝(NASH)
研发公司:Gilead Sciences
临床进展:2期
关键日期:近期公布2期临床结果

新药简介:
GS-0976是一个在研乙酰辅酶A羧化酶(ACC)抑制剂。ACC催化脂肪从头合成途径的第一步,脂肪酸的合成。抑制ACC可以减少脂肪酸合成,从而降低肝脏脂肪含量和硬化程度。
GS-0976的2期临床试验将在近期公布结果。这是一项随机、双盲、安慰剂对照的研究。研究将评估在125例NASH患者中,两种剂量的GS-0976治疗12周期间的安全性,耐受性和有效性。项目将评估治疗组与对照组的肝脏脂肪含量和肝脏纤维化标志物等指标。在此前的1期研究中,来自10名患者的数据显示接受GS-0976患者的肝脏脂肪含量相对下降了43%,这一积极结果让人们对此项2期临床研究结果翘首以待。Gilead预期在近期完成结果统计并公布数据。







