
2月17日,Catalyst制药公司宣布收到FDA针对其Firdapse(amifampridine phosphate)NDA的“拒绝申请信“(Refusal to File,RTF)。Firdapse被Catalyst公司开发用于治疗Lambert Eaton肌无力综合征(LEMS)以及先天性肌无力综合征(CMS。FDA在RTF中指出Catalyst公司2015年12月提交的申请资料不完整,需要补充更多支持性信息,并未对Firdapse相关临床数据的可接受性做出结论,也未对Firdapse的疗效和安全性做出评价。Firdapse之前曾被FDA授予治疗LEMS和CMS的孤儿药资格以及治疗LEMS的突破性药物资格。
2月23日,PTC Therapeutics公司宣布收到FDA针对其Translarna (ataluren )NDA的拒绝申请信。Ataluren是first in class的口服性蛋白修复药物,用于治疗无义突变型杜氏肌营养不良(nmDMD),曾于2014年8月获得欧盟有条件批准。FDA在RTF中指出PTC的该项申请资料不完整,无法进入后续审评流程。
关于RTF
RTF和完全回复信(CRL)对申请人而言都不是好消息。区别在于,CRL是FDA已经受理申请人的某项申请,但是经过审评后认为该申请不足以获得批准,以CRL的形式指出申请中存在的问题。RTF则是FDA在收到申请人递交的申请后,经过初审直接拒绝,该申请不被受理。
RTF的作用在于帮助FDA药品评价与研究中心(CDER)合理配置审评资源,不要把精力浪费在资料不完整的申请(包括NDA,sNDA,BLA,sBLA)或者原本应该以ANDA形式提交的NDA上面。CDER认为,RTF可以在更早期提示申请人在研究中存在的重大缺陷,可以避免审评阶段的资源浪费,有利于安全有效的药物更早获批上市。关于RTF的更多介绍可点击“阅读原文”下载查看FDA官方文件。
FDA在PDUFA V实施期间表现出史无前例的开放和透明,新药批准数量也不断攀升。生物制药公司和投资人似乎迎来了新药开发环境无比宽松的年代,生物技术股的股价也一飞冲天。不过FDA在过去的1周针对两个临床急需药物发出RTF似乎也释放了一个审批趋严的信号。
可能是因为审批环境显得过于轻松让申请人开始自得意满了,药品申请资料的提交也开始随意起来。尽管Catalyst和PTC对外披露FDA仅仅是因为资料不完整而发出了RTF,但是要知道自从2011年以后,RTF就是个稀罕物了,自从PDUFA V于2012年10月生效后FDA仅发出了3封RTF,如今一周内连发2封RTF绝不是偶然。RTF的出现频率在1998-2011年期间开始上升,常见原因主要包括临床数据、CMC资料、电子提交文件存在缺陷等。
2010年以后披露的RTF
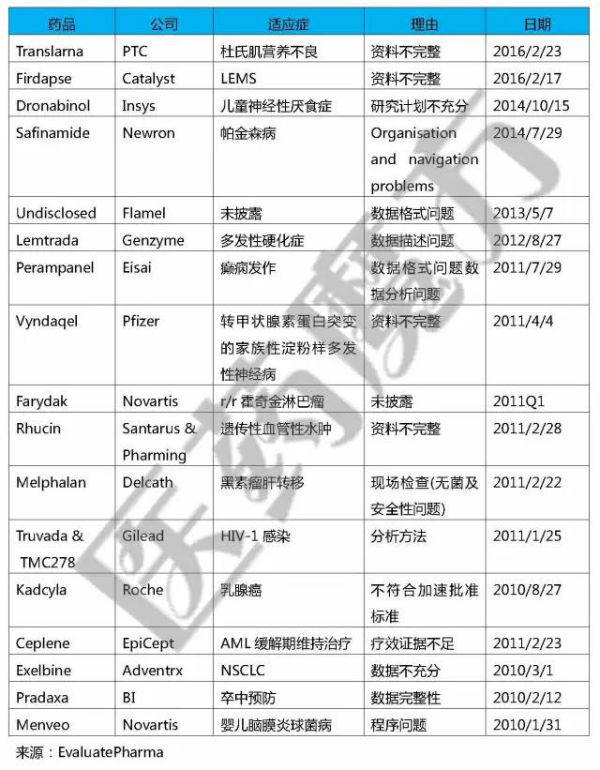
由上可知,辉瑞、诺华、罗氏等巨头也都收到过RTF,想到这里大家可能会对FDA过去1周发布的RTF不以为然。回顾历史,Imclone Systems公司的Erbitux在2001年也收到了RTF,其CEO SamWaksal在知道这个坏消息的情况下告知其亲戚抛售股票,最终因为证券欺诈锒铛入狱。
FDA吼一吼,上市公司抖三抖
在宣布收到FDA的RTF之后,PTC公司的股价在23日跌去62%,另外两家知名的杜氏肌营养不良(DMD)药物开发公司Sarepta和BioMarin的股价也分别跌去7%和4%。
由于DMD是一种进行性疾病,在不经治疗的情况下,大多数患儿会在十几岁完全丧失行动能力,在二三十岁死亡。美国大约有1.5万~2万DMD患儿,但目前FDA未批准任何治疗DMD的药物。Sarepta和BioMarin为争夺美国市场首个上市的DMD药物也是打得不可开交(eteplirsen vs drisapersen)。尽管面临患者家属和社会的巨大压力,FDA此次直接拒绝2个DMD药物的NDA所表明的态度也很明确——拒绝受摆布,按我的标准来!
DMD药物管线








