糖尿病是全球对人类健康有害的且最难根治的代谢疾病之一。最近的研究发现,糖尿病发展过程中慢性炎症反应是导致其不可逆转的关键因素,但这一过程的机制并不清楚,因而尚无有效的干预策略。
2023年9月28日,山东大学于晓教授团队,北京大学焦宁教授团队联合孙金鹏教授团队在Nature Metabolism 在线发表了题为 “Functional screening and rational design of compounds targeting GPR132 to treat diabetes” 的研究论文,这项研究发现氧化脂肪酸脂代谢产物激活GPR132对胰岛驻留型巨噬细胞重编程发挥重要的调控作用,是促发胰岛炎症的重要原因之一。进一步,联合研究团队通过阐明GPR132识别内源性配体9(S)-HODE,NPGLY并激活的分子机制,结合计算机辅助药物设计、合成药物化学以及药理学检测评估手段开发了靶向GPR132的高亲和力及选择性拮抗剂候选小分子NOX-6-18,能够显著改善糖尿病小鼠的胰岛炎症,并提高糖代谢稳态,为治疗糖尿病提供了新的思路。

哺乳动物细胞中的脂质代谢是复杂的,目前知道有四种主要形式:首先,脂质可通过磷脂的生物合成和膜的生物发生过程形成细胞和胞内细胞器膜。第二,作为体内主要能量分子ATP生产的备用能源。第三,代谢为多种脂质分子,作为信号分子以选择性和特异性的方式激活受体来调节细胞功能。第四,脂质以形成甘油三酯的形式储存在脂肪组织中。已有的研究表明,脂质信号调节通路对维持糖代谢稳态发挥着重要的作用,比如,美国加州大学Jerrold M Olefsk教授团队发现鱼油中omega-3脂肪酸以及内源性脂质如PAHSA可以通过GPR120发挥抗炎和胰岛素增敏的作用(Cell. 2010 Sep 3;142(5):687-98.)。于晓教授联合孙金鹏教授团队发现胰岛中内源性LCFA-GPR120环路对于胰岛稳态发挥重要作用以及引起不同下游信号通路响应的分子机制(Diabetes. 2022 Jul 1;71(7):1454-1471.;Science. 2023;380(6640):eadd6220.)。在1型和2型糖尿病的进展过程中,糖尿病并发的脂质代谢紊乱也加重了糖尿病的进程,高水平的饱和游离脂肪酸会导致组织和细胞中氧自由基的过量产生,与糖耐量受损的发展有关,且是糖尿病肾病、糖尿病视网膜病变和糖尿病神经病变等严重并发症的关键因素(Physiol. Rev, 93 (1) (2013), pp. 137-188.; Diabetologia, 48 (4) (2005), pp. 752-755)。此外糖尿病的发展通常伴随脂质过氧化产物的增加,如12-HETE, LTB4等也被发现可能通过选择性激活G蛋白偶联受体介导各种炎症和过敏反应(J. Biol. Chem, 286 (39) (2011), pp. 33832-33840.; J. Exp. Med, 192 (3) (2000), pp. 439-446.), 这些氧化脂肪酸代谢产物可能在糖尿病的外周并发症的病因中起重要作用(Sci. Signal, 8 (361) (2015), p. ra10.)。研究脂质代谢小分子对各种代谢器官和组织的调控作用是近年来内分泌和代谢学科的研究难点和热点。
目前的科学研究表明,胰岛环路障碍是糖尿病发生的核心因素之一。比如,美国加州大学Huising教授研究团队和于晓教授团队发现尿皮质素3 (UCN3)介导的β细胞-δ细胞相互作用在糖尿病发生发展过程中发挥关键作用(Nat Med. 2015 Jul;21(7):769-76,J Clin Invest. 2017;127:2631-2646; Nat Commun. 2022 Nov 5;13(1):6670)。延续这一工作,于晓教授发现,敲除胰岛δ细胞,会导致围产期小鼠胰岛素水平异常升高和小鼠低血糖死亡(Cell Death Dis. 2018;9:682.),以及胰岛内源性脂肪酸激活GPR120调控胰岛 δ 细胞-β 细胞环路引起不同下游信号通路响应的分子机制(Diabetes. 2022 Jul 1;71(7):1454-1471.;Science. 2023;380(6640):eadd6220.)。平行于胰岛 δ 细胞-β 细胞环路,胰岛β 细胞-巨噬细胞环路也逐渐得到大家的重视。比如说,在1型和2型糖尿病(分别为T1DM和T2DM)背景下,胰岛驻留型巨噬细胞发生重编程并与胰岛内的其他细胞产生信号交流,并参与胰岛的稳态调节以及胰岛病理条件下的炎症反应(Cell Metabolism, 29(2): 457-474; Cell Metabolism, 34(2): 240-255; Nature Reviews Endocrinology, 16(2): 81-90)。而从胰岛β 细胞出发,于晓教授团队最近也发现了胰岛β细胞中的孤儿受体OLFR109可以识别胰岛素肽insB:9-23,通过“刹车机制”控制胰岛素分泌的数量和速度。持续长期的insB:9-23刺激,激活胰岛β细胞-巨噬细胞环路,促进巨噬细胞增殖,损害胰岛稳态,阐明了胰岛β细胞嗅觉受体olfr109与胰岛巨噬细胞之间的细胞通讯对胰岛稳态的调控机制(Cell Metabolism. 2022;34(2):240-255;Trends Cell Biol. 2023 Jun;33(6):463-476.)。值得注意的是,南京医科大学韩晓教授研究发现在高脂等压力条件下胰岛β细胞释放外泌体miR29与单核/巨噬细胞作用,加剧胰岛炎症(Cell Rep, 2021. 34(1): p. 108576)。
尽管以上这些研究已广泛揭示胰岛驻留型巨噬细胞介导的炎症以及脂质代谢平衡在糖尿病发展中的关键作用,但是胰岛驻留巨噬细胞是如何启动重编程并诱导胰岛炎症信号的,其机制尚不清楚,胰岛巨噬细胞介导的炎症也缺乏有效干预手段。
为解决这一问题,联合研究团队通过代谢组学的手段观察发现,糖尿病小鼠胰岛内的一种特定氧化脂肪酸9(S)-HODE含量显著增加,并通过选择性激活胰岛驻留巨噬细胞上的GPR132,一种在巨噬细胞特异性高表达的脂类感知受体,它的激活启动了胰岛驻留型巨噬细胞的重编程来促进胰岛细胞的炎症反应。而胰岛巨噬细胞特异性敲除GPR132可显著改善高脂引起的糖代谢紊乱。
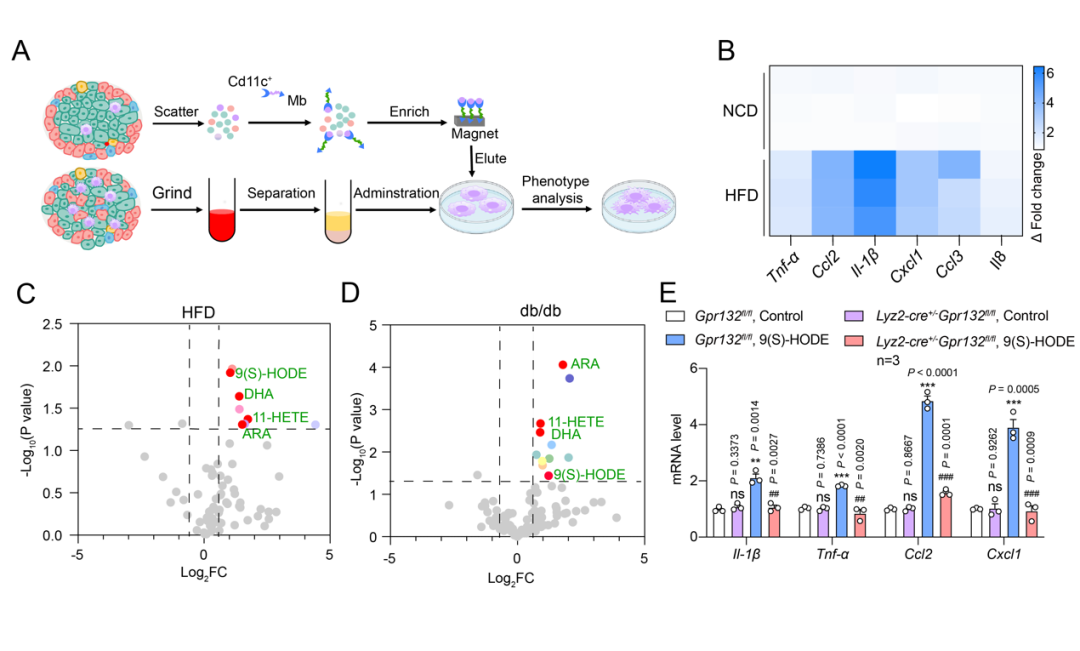
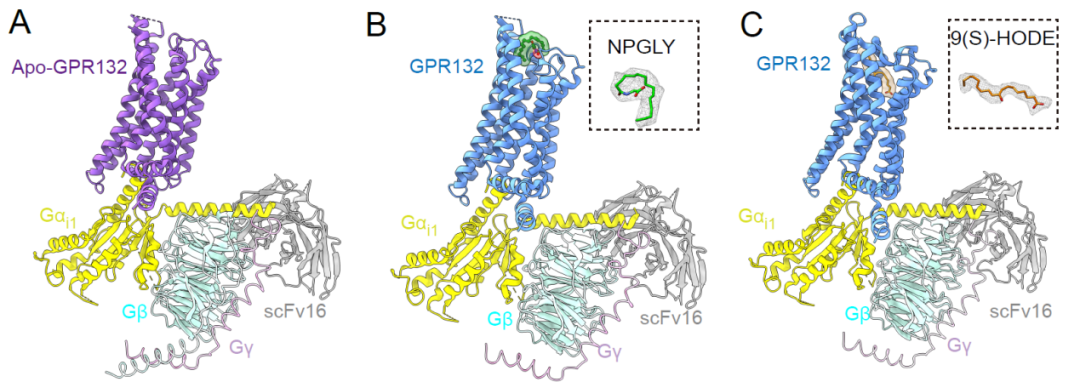
接下来,为了确定反转9(S)-HODE-GPR132-Gi信号轴是否可以减少糖尿病进展过程中的胰腺炎症,改善葡萄糖代谢,需要获得GPR132的高选择性激动剂和拮抗剂。联合团队中的焦宁教授是国际上著名的有机化学和药物化学专家。焦宁教授团队前期针对代谢类疾病的药物发现积累了多年的研究经验,创建了基于新合成方法学的药物合成和修饰方法,构建了新结构化合物库 (Nature. 597(7874) (2021):64-69.; Science. 367(6475) (2020):281-285.; Nat. Catal., 3 (2020), 107-115.; Nat Chem., 11(1) ( 2019):71-77.);已经发现了多个靶向代谢性疾病的候选药物分子。研究团队于是从解析其对内源性配体识别机制和GPR132受体激活的机制入手,开展靶向GPR132的高选择性激动剂和拮抗剂发现研究。研究团队解析了NPGLY-GPR132-Gi和9(S)-HODE-GPR132-Gi复合物的冷冻电镜结构。对结构进行分析发现,两种内源性配体通过两个不同的口袋与GPR132受体结合,NPGLY占据配体结合口袋左侧使口袋呈“L”形,而9(S)-HODE具有更深的配体结合位置,这表明GPR132上有两个“正构位点”,既说明了其配体口袋的可塑性也为基于结构设计小分子激动剂和拮抗剂带来了挑战。
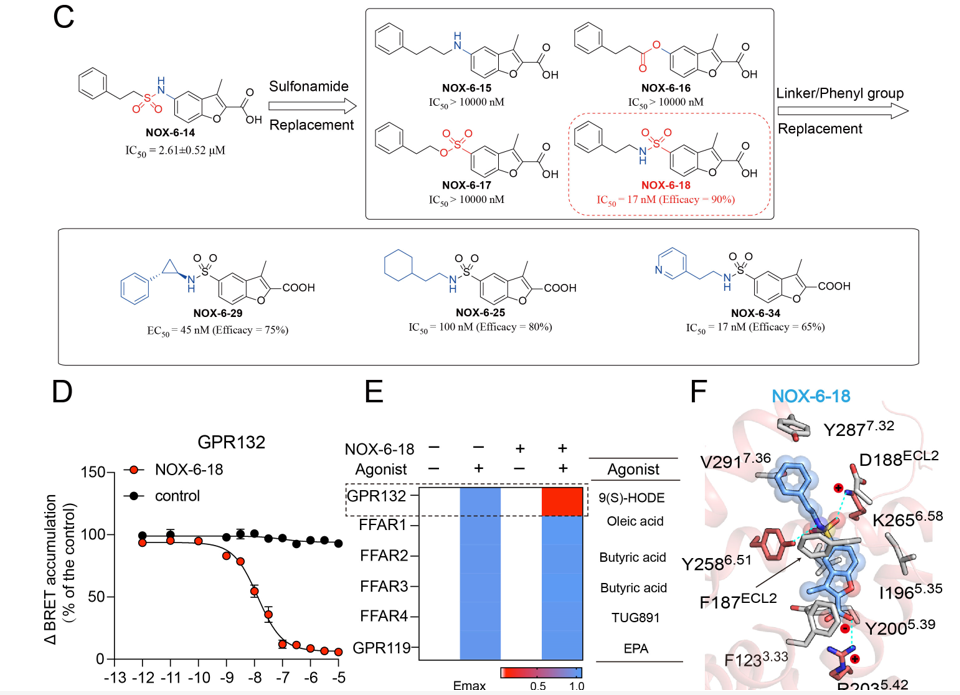
联合研究团队于是进行了分子动力学模拟,分别计算了两个“正构位点”残基的能量贡献,并结合突变验证,确定了配体设计的热点残基。通过虚拟筛选研究团队NOX多样性小分子化合物库,发现苗头化合物NOX-6-1(EC50约为1124nM),结合理性药物设计、合成药物化学和药理学表征,最终成功地发现GPR132选择性激动剂NOX-6-7(EC50约为30nM)。此外,研究团队通过将弱激动剂NOX-6-1中酰胺连接改为磺酰胺连接,发现其不仅消除了Gi的活性,并拮抗了内源性配体激活Gi活性。研究团队采用分子动力学模拟、FlAsH-BRET和生化实验相结合的方法来评估化合物的结合位置,发现了GPR132拮抗剂与激动剂之间转变的关键作用残基,最终找到了GPR132的强效选择性拮抗剂NOX-6-18(IC50约为14nM)。
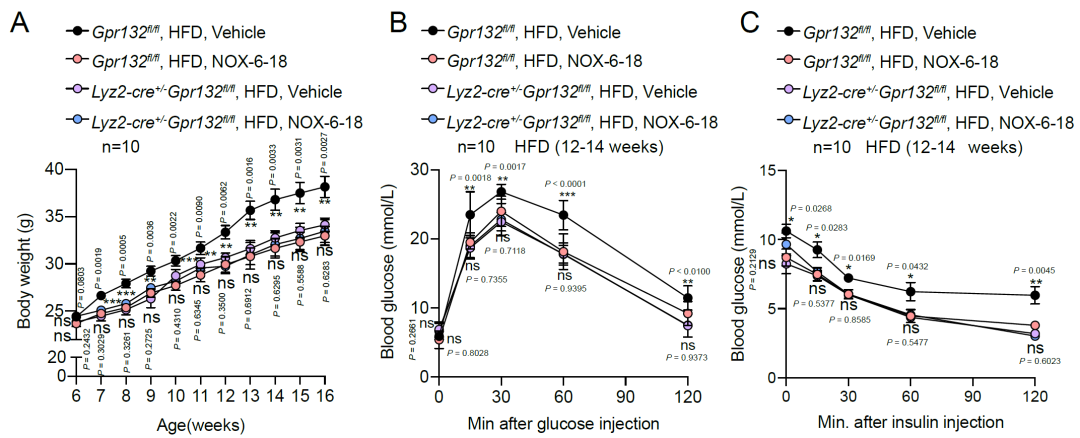
最后,研究团队在2型糖尿病小鼠模型HFD小鼠上对NOX-6-18针对糖尿病及葡萄糖代谢的治疗效果进行评估,发现NOX-6-18 给药4-6周,高脂小鼠葡萄糖耐量得到改善,这很大程度归因于NOX-6-18在早期阶段对胰岛功能的改善。NOX-6-18给药12-14周以后能够显著改善高脂小鼠的体重,葡萄糖耐量以及胰岛素耐量,并且空腹血糖及胰岛素含量也得到改善。同时NOX-6-18显著降低了胰岛、肝脏和脂肪组织的炎症水平,进而改善了代谢紊乱。综上所述,该研究结果表明内源性氧化脂肪酸9(S)-HODE-GPR132信号通路在胰岛驻留型巨噬细胞重编程以及胰岛炎症中发挥重要作用,靶向GPR132开发的高选择性及高亲和力拮抗剂NOX-6-18能够显著降低胰岛的炎症反应,改善葡萄糖代谢,为糖尿病的治疗提供了新的治疗思路。
北京大学博士生王佳乐、博士后豆晓东,山东大学特别资助类博士后程杰、博士生高明新,北京大学博士生徐国峰、丁金辉及中科院物理所副主任工程师丁玮为本文的共同第一作者;于晓教授,焦宁教授和孙金鹏教授为本论文的共同通讯作者。
于晓教授课题组长期从事内分泌生理和糖尿病的研究,聚焦于胰岛内分泌组织的细胞间环路和GPCR跨膜信号转导对胰岛稳态的维持,以通讯作者在 Nature(2篇),Science(封面文章),Cell(封面文章),Cell Metab,Nature Metab,Nat Chem Biol (2篇),J Clin Invest,PNAS,Diabetes,Nat Commun(2篇)等杂志发表论文40余篇, 在胰岛细胞环路对胰岛稳态调控和GPCR在胰岛中的功能研究方面居于国际前沿水平;焦宁教授课题组长期致力于合成方法学、分子骨架编辑、药物高效合成及筛选、基于代谢类疾病的新药发现等研究,以通讯作者在Nature,Science,Nat. Chem.,Nat. Catal.,Nat. Metab.,CCS. Chem.等期刊发表论文190余篇,在绿色氧化反应,氮化反应,卤化反应等研究中取得了一系列创新性成果,并发现多个针对代谢综合征以及用作光动力治疗的候选药物分子。孙金鹏教授课题组长期聚焦于微环境药理学,系统性的研究了膜受体感知微环境并调控生理功能的机制,以通讯作者在 Nature (x6),Science (封面),Cell (x2,封面1篇),Cell Metab,Nature Metab,Nat Chem Biol (x3),Cell Research (x2),PNAS (x5),Nat Commu (x7)等知名杂志发表90余篇论文,在膜受体对微环境感知和配体识别方面处于国际研究前沿。该项研究得到国家重点研发计划基金、国家杰出青年科学基金、自然基金委重点基金、重大项目、山东省重点研发计划、昌平实验室和新基石科学基金的支持。
专家点评:
赵家军:山东省立医院院长,山东省立医院内分泌代谢科学科带头人,“泰山学者”攀登计划特聘专家,山东省科技最高奖获得者,中华医学会内分泌分会主任委员,第十四届全国政协常委。
糖尿病的危害有很多,酮症酸中毒、低血糖以及高渗昏迷等急性并发症,在急性发作时甚至可能危及生命。而由糖尿病引起的血管病变,即大血管和微血管损伤,进而导致的慢性并发症,如心血管病、脑血管病、糖尿病肾病、糖尿病视网膜病变、肿瘤等,会直接影响糖尿病患者的寿命与生活质量,给社会和家庭带来沉重的负担(BMJ. 2020 Apr 28;369:m997.;JAMA Cardiol. 2019 Sep 1;4(9):874-883.)。
从发现胰岛素开始,学术界对糖尿病的认识逐渐深入,相关治疗药物研发急速发展,靶向糖尿病进程中各个靶点的药物也都相继问世,使得人们对于血糖控制有了越来越大的把握。但是,仅仅控制了血糖的变化并不能高枕无忧。比如,使用胰岛素促泌剂类降糖药后,虽然血糖达标了,但体重上升了。中国70%以上的2型糖尿病患者同时伴有高脂血症。高血脂会引起动脉粥样硬化,是糖尿病引发血管病变的一个关键因素,继发的脂代谢异常同样也会对胰岛,肝脏,脂肪的稳态产生重要影响。因此糖尿病需要综合管理,防控中最重要的因素之一是脂代谢异常。
脂质不仅是人体三大营养物质之一,作为人体的备用能源维持人体的正常生理活动,通常也作为信号分子广泛参与细胞信号调控,影响机体各项机能,例如此前的研究发现ω-3脂肪酸具有抗炎和预防代谢性疾病/心血管疾病的功效等(JAMA Cardiol. 2019 Sep 1;4(9):874-883.)。脂代谢紊乱引起的各类脂代谢产物异常积累对胰岛环路有哪些影响,目前还需要更加深入的研究。
最近的研究发现,肥胖会诱导胰岛内驻留性巨噬细胞的局部扩增,在功能上,胰岛内巨噬细胞以细胞间接触依赖的方式损害β细胞功能。但是在这个过程巨噬细胞与胰岛β细胞之间的细胞环路如何发挥作用仍未可知,因此,研究胰岛巨噬细胞与β细胞环路的调控机制以及糖尿病进程中的变化,靶向设计药物可能是治疗糖尿病及其严重并发症的新策略。
针对这些重要的科学问题,内分泌专家于晓教授,药物化学专家焦宁教授和GPCR药理学专家孙金鹏教授团队通力合作,通过代谢组学的手段检测到氧化脂质9(S)-HODE选择性激活胰岛驻留性巨噬细胞上的GPR132并启动Gi信号途径,发挥对胰岛驻留型巨噬细胞的重编程的调控作用,促进胰岛炎症,接着通过解析不同内源性脂质与GPR132-Gi蛋白复合物的高分辨率冷冻电镜结构,揭开了不同脂质结合GPR132受体激活G蛋白的分子机制。进一步结合系统药理学分析、计算生物学和细胞功能实验,找到了GPR132的强效选择性激动剂,并在此基础上衍生出了强效选择性拮抗剂NOX-6-18,最终在2型糖尿病小鼠模型上进行了功能验证。NOX-6-18给药后能够显著改善了高脂小鼠巨噬细胞重编程,在整体表型上体重,葡萄糖耐量,胰岛素耐量,空腹血糖及胰岛素含量都得到了改善。同时NOX-6-18显著降低了胰岛、肝脏和脂肪组织的炎症水平,进而改善了代谢紊乱。这些重要成果不仅是理论上的重大突破,也为为糖尿病的治疗提供了新的治疗思路。
孟卓贤:浙江大学基础医学院,国家优青,浙江大学“百人计划”研究员、博士生导师。
社会经济的发展伴随着2型糖尿病(type 2 diabetes, T2D)发病率逐年升高,已成为席卷全球的公共卫生危机,严重危害人类健康,造成了巨大的社会负担和经济损失。糖尿病是一种以胰岛素抵抗和β细胞功能障碍引起的高血糖为特征的代谢性疾病,是由遗传和环境因素共同作用引起的。进食后血糖水平升高,胰岛β细胞首先感受血糖水平变化,分泌胰岛素,进而促进外周组织如骨骼肌摄取葡萄糖,使血糖维持在正常范围,这个过程中β细胞的重要性不言而喻。骨骼肌细胞中也存在葡萄糖感受通路,能够直接感受血糖水平的动态变化,与传统的胰岛素信号通路协同作用,在正常餐后血糖的维持和糖尿病高血糖发生发展过程中发挥重要作用(Mol Cell. 2017;66(3):332-344.e4)。
在T2D进程中,β细胞经历了由代偿到失代偿的动态变化。在疾病早期,应对包括糖脂毒性、内质网应激、氧化应激、炎症因子在内的代谢应激因子的刺激,β细胞启动代偿反应:代偿性增强单个细胞的胰岛素分泌功能,通过增殖增加细胞数量,以响应日益增加的胰岛素需求;随着疾病的进展,代谢应激因子经年累月的刺激对β细胞产生不可逆的损伤,使β细胞代偿能力丧失,出现细胞去分化、转分化甚至凋亡。利用高脂饮食(HFD)诱导的肥胖和T2D小鼠模型,我们近期研究系统描绘了T2D进程中胰岛β细胞功能和多组学动态变化全景图谱,并在此基础上阐明了饮食干预通过CTCF介导的转录重编程改善T2D胰岛β细胞功能损伤和葡萄糖代谢紊乱(J Exp. Med. 2022; 219 (7): e20211779)。值得一提的是,胰岛β细胞除了与胰岛δ和α细胞进行信号交流外,胰岛巨噬细胞也可以通过分泌可溶性因子,如IL-1β,TNF-α等,或者直接通过细胞-细胞接触的方式损害β细胞功能(Diabetes, 2006. 55(10): p. 2713-22, Diabetologia, 2014. 57(8): p. 1645-54, Cell Metab, 2019. 29(2): p. 457-474.e5)。近年来,胰岛β 细胞-巨噬细胞之间的相互作用逐渐得到大家的重视。例如胰岛巨噬细胞可通过分泌PDGFα促进胰岛β细胞的代偿性增殖等调控胰岛稳态,同时胰岛中驻留巨噬细胞的增殖也受到了β细胞释放的ATP的调节(Diabetologia, 2018. 61(1): p. 182-192, J Exp Med, 2017. 214(8): p. 2369-2385, Nat Rev Endocrinol, 2020. 16(8): p. 448-466)。其中值得一提的是,南京医科大学韩晓教授研究发现在高脂等压力条件下胰岛β细胞释放外泌体miR29与单核/巨噬细胞作用,加剧胰岛炎症(Cell Rep, 2021. 34(1): p. 108576) 。胰岛β细胞-巨噬细胞环路的正常维持,以及他们在糖尿病病理过程中的变化,并开发针对性的药物,有望成为发展出改善糖尿病稳态和胰岛退分化的新型疗法。
山东大学于晓教授长期从事糖尿病中胰岛环路以及GPCR的功能研究。最近,于晓教授联合北京大学焦宁教授和孙金鹏教授等在Nature metabolism发表的这篇文章首先运用代谢组学的手段发现氧化脂肪酸9(S)-HODE通过选择性激活胰岛驻留巨噬细胞上的GPR132,启动了胰岛驻留型巨噬细胞的重编程来促进胰岛的炎症反应。接下来结合冷冻电镜结构生物学和计算生物学等研究手段,作者发现了GPR132上有两个“正构位点”,说明了其配体口袋的可塑性。进一步通过分子动力学模拟和药理学表征,作者找到了靶向胰岛驻留型巨噬细胞GPR132的强效选择性拮抗剂:NOX-6-18。接着,作者在HFD 喂养的小鼠模型上评估了NOX-6-18对肥胖和糖尿病的治疗效果,发现NOX-6-18后能够显著减轻HFD诱导的小鼠体重增加、葡萄糖耐量受损以及胰岛素抵抗,伴随空腹血糖及胰岛功能的显著改善。机制方面,研究人员发现NOX-6-18显著降低了胰岛、肝脏和脂肪组织的炎症水平,进而改善全身代谢紊乱。总之,这些重要研究发现阐明了胰岛内巨噬细胞与β细胞互作的新机制,为靶向胰岛驻留型巨噬细胞治疗胰岛β细胞功能损伤和糖尿病提供了新方向和新依据。