导读:德国科学家目前发现,分子伴侣 DnaK 是折叠过程中的一个关键成分。MPIB的主任Ulrich Hartl称:“鉴于阿尔茨海默氏症或帕金森等疾病中的蛋白质折叠出错,对这些机制的理解变得尤其重要。”
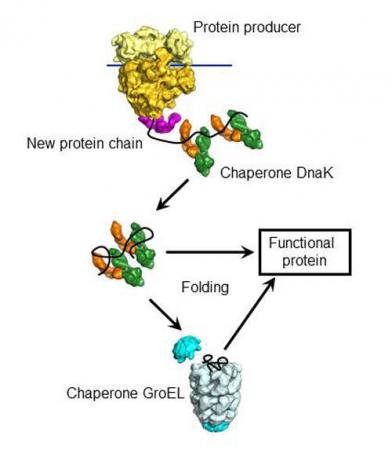
DnaK分子伴侣结合在新蛋白质上,介导其折叠。 (来源:马克斯•普朗克生物化学研究所)
蛋白质是细胞中的构件分子和功能载体,涉及了几乎所有的生物过程。为了完成任务,蛋白质需要被折叠成复杂的三维结构。德国马克斯•普朗克生物化学研究所(MPIB)的科学家目前发现,DnaK分子伴侣(chaperone)是折叠过程中的一个关键成分。MPIB的主任Ulrich Hartl称:“鉴于阿尔茨海默氏症或帕金森等疾病中的蛋白质折叠出错,对这些机制的理解变得尤其重要。”
研究人员的研究成果已经发表在《细胞报告》(Cell Reports)。
蛋白质负责几乎所有的生物学功能,人体细胞合成了数千种以氨基酸链为形式的蛋白质。为了发挥生物学功能,这些氨基酸链必须折叠成复杂的3维模型。当折叠过程中出现错误时,编码的蛋白质可能成为无用的甚至是有害的团块,所有的细胞(如细菌和人类)因此进化出一种分子伴侣网络,从而帮助其它蛋白质正确折叠。
MPIB科学家目前已经研究出大肠杆菌中的分子伴侣网络。通过蛋白质组学的分析,他们发现不同的分子伴侣在折叠过程中如何协作。Ulrich Hartl解释道:“我们识别出具有转盘功能的Hsp70蛋白DnaK,它是分子伴侣网络中的核心成分。”随着目标蛋白质的合成,DnaK会结合在约700种不同的蛋白质上,此外,DnaK介导大多数蛋白质链的折叠,那些不能折叠的蛋白质被转移到另一种分子伴侣——桶状的GroEL,后者是高度特化的折叠机器,形似纳米笼,能够支持单一蛋白链的暂时闭合和折叠,从而避免外部影响。
分子伴侣网络的干扰
当分子伴侣网络受到干扰时,什么情况会发生。从细胞中移除GroEL时,它的“客户蛋白质”会积累在DnaK旁,后者把它们运送到蛋白酶去分解。生化学家称:“很显然,DnaK觉察这些接触的蛋白质链不能成为有用的成熟分子。”与大肠杆菌的相比,人类细胞中的分子伴侣网络具有相似性,当然也表现出较为复杂性。鉴于神经退行性疾病中蛋白质折叠错误,对这些反应的认识变得尤其重要。

 DnaK Functions as a Central Hub in the E. coli Chaperone Network.
DnaK Functions as a Central Hub in the E. coli Chaperone Network.
Giulia Calloni, Taotao Chen, Sonya M. Schermann, Hung-chun Chang, Pierre Genevaux, Federico Agostini, Gian Gaetano Tartaglia, Manajit Hayer-Hartl, F. Ulrich Hartl.
Cellular chaperone networks prevent potentially toxic protein aggregation and ensure proteome integrity. Here, we used Escherichia coli as a model to understand the organization of these networks, focusing on the cooperation of the DnaK system with the upstream chaperone Trigger factor (TF) and the downstream GroEL. Quantitative proteomics revealed that DnaK interacts with at least 700 mostly cytosolic proteins, including 180 relatively aggregation-prone proteins that utilize DnaK extensively during and after initial folding. Upon deletion of TF, DnaK interacts increasingly with ribosomal and other small, basic proteins, while its association with large multidomain proteins is reduced. DnaK also functions prominently in stabilizing proteins for subsequent folding by GroEL. These proteins accumulate on DnaK upon GroEL depletion and are then degraded, thus defining DnaK as a central organizer of the chaperone network. Combined loss of DnaK and TF causes proteostasis collapse with disruption of GroEL function, defective ribosomal biogenesis, and extensive aggregation of large proteins.
文献链接:https://www.cell.com/cell-reports/abstract/S2211-1247(11)00017-9







