研究意义
自身免疫性疾病与个体遗传学特征,个人免疫系统,外界环境等有密切关系,有关自身免疫疾病的发病机制,特别是非编码RNA在其中的调控角色还不是很清楚。 来自上海交通大学医学院王宏林(Honglin Wang)教授实验室的研究人员近期在《自然通讯》(Nature Communications)杂志上发表了两篇有关miRNA在自身免疫性疾病中的调控作用研究成果,为更好的理解自身免疫性疾病的发病机制以及 miRNA可能在自身免疫疾病中的治疗前景提供了有力证据。
研究思路

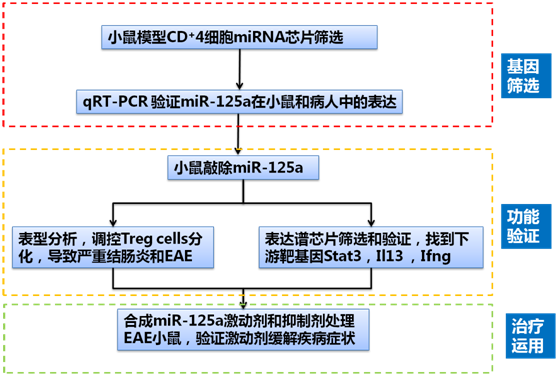
在第一篇文章中,研究人员首先通过芯片检测了人红斑狼疮症的MRL/lpr小鼠模型和多发硬化症(EAE)小鼠模型脾脏CD4+ T细胞,发现miR-125a-5p显著性下调。qRT-PCR验证显示,相比正常人,系统系红斑狼疮病病人和克罗恩病病人的 miR-125a表达下调。这些结果证明,miR-125a在小鼠模型和人的自身免疫性疾病中是特异性下调的。
为了进一步探究miR-125a功能,研究人员在小鼠模型中敲除了miR-125a。流式细胞分析发现,miR-125a的敲除影响了T细胞向调节性 T细胞(Treg cells)的分化。而这种变化使小鼠从免疫抑制转换为炎症,导致了更严重的结肠炎和实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)发病。
为理解miR-125a的分子功能,研究人员将miR-125a敲除小鼠和对照小鼠的CD4+CD25hi Treg细胞进行了表达谱芯片检测。结果显示辅助T细胞通路相关基因表达发生变化。结合miRNA靶基因预测,荧光素酶报告系统检测和后期实验结果,发现 miR-125a可抑制T细胞效应因子Stat3,Il13 ,Ifng的表达。
研究人员通过人工合成不同剂量miR-125a,转化CD4+ T细胞,发现内源的转录因子Stat3蛋白产生剂量依赖的表达抑制,Ifng 和Il13的mRNA表达也显著性降低。
为了探究miR-125a的临床治疗前景,研究人员将合成的miRNA激动剂和抑制剂注射多发性硬化症(EAE)小鼠,发现小鼠的症状在激动剂下显著好转,抑制剂下症状更加严重。
这些研究表明,在控制自身免疫性疾病过程中,miR-125a通过调控T细胞效应因子Stat3,Il13 ,Ifng的表达,影响了调节性T细胞的免疫稳态过程。这些结果为理解miRNA在自身免疫性疾病中的调控作用及miRNA用于免疫性疾病的治疗作用提供 了强有力的依据。该研究中Affymetrix GeneChip Mouse Genome 430 2.0芯片服务由上海伯豪生物技术有限公司提供。


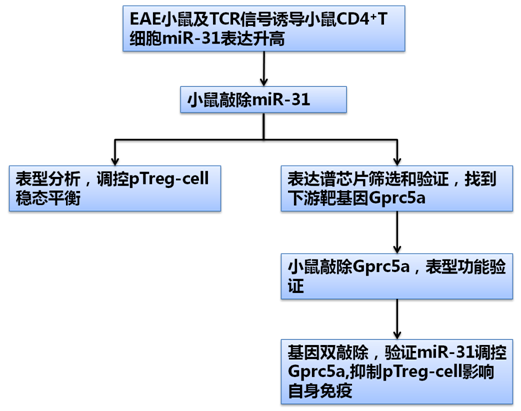
在第二篇文章中,研究人员首先检测了多硬化症小鼠模型(EAE)CD4+T细胞,发现miRNA-31表达比正常小鼠明显升高。用TCR信号 (plate-coated anti-CD3-和 soluble anti-CD28-特异性抗体)刺激初始T细胞,发现miR-31的表达显著增加。在体外诱导Treg细胞(iTreg)细胞中,miR-31表达减 少,TH1,TH17细胞中表达增加。ChIP实验表明,FoxP3可能通过结合miR-31启动子区进而影响了iTreg细胞中的miR-31表达。
为了进一步探究miR-31的功能,研究人员条件性地敲除了CD4+T细胞中的miR-31,然后诱导EAE,发现敲除小鼠的症状比对照组明显减弱。 进一步检测发现,在发炎的脾脏和中枢神经系统中,敲除小鼠的TH1和TH17比例明显减少,而外周Treg-cell(pTreg)的比例和总数却明显增 加,表明miR-31影响了外周Treg-cell的稳态平衡。同时,通过分离初始T细胞后发现,敲除小鼠T细胞有更多的pTreg-cell产生,这对 于EAE的发展起重要作用。
为了确认miR-31的具体功能机制,研究人员通过表达谱芯片和预测发现,敲除miR-31小鼠中的Gprc5a表达上升。荧光素酶报告系统证实,miR-31可靶定Gprc5a的3’UTR区进而调控其表达。
通过检测诱导EAE和对照小鼠,研究人员发现Gprc5a的mRNA表达量和蛋白表达量明显升高。在小鼠中敲除Gprc5a后,iTreg-cell 明显减少。把敲除小鼠进行EAE诱导,pTreg-cell的比例明显少于对照,症状也比对照组严重。当把小鼠施与miR-31和Gprc5a双敲 除,EAE的症状严重程度恢复了miR-31单敲除时的减轻,表明在EAE发展过程中,miR-31通过调控Gprc5a来起作用。
这些研究结果表明,在自身免疫过程中,miR-31通过调控Gprc5a的表达,抑制了pTreg-cell的形成,通过调控miR-31及其靶基因可以对自身免疫反应进行定向调节。该研究中Mouse genome-wide cDNA microarray服务由上海伯豪生物技术有限公司提供。

研究亮点
这两篇文献都是对自身免疫性疾病发病机制中miRNA的作用进行了报道,两篇文献有相似的研究背景,相似的实验设计,但是侧重点不同,各有千秋。在第一篇 研究中,除了研究miRNA在自身免疫性疾病中的作用,芯片寻找下游靶基因外,还用外源合成miRNA激动剂和抑制剂进行了靶向治疗尝试,可以说是机制和 运用的完美结合。在第二篇研究中,有着类似第一篇一样研究思路,但是在miRNA对靶基因的调控机制,以及他们之间如何具体影响自身免疫疾病发展等方面做 了更加详细的研究,可以说是一片非常优秀的信号通路研究文献。