近日,由北京雅康博生物科技有限公司自主研发的人KRAS 基因突变检测试剂盒(荧光 PCR 法)通过国家药品监督管理局(NMPA)的审核,正式获批第三类医疗器械注册证(国械注准20213401103)。


图片来源:国家药品监督管理局官网
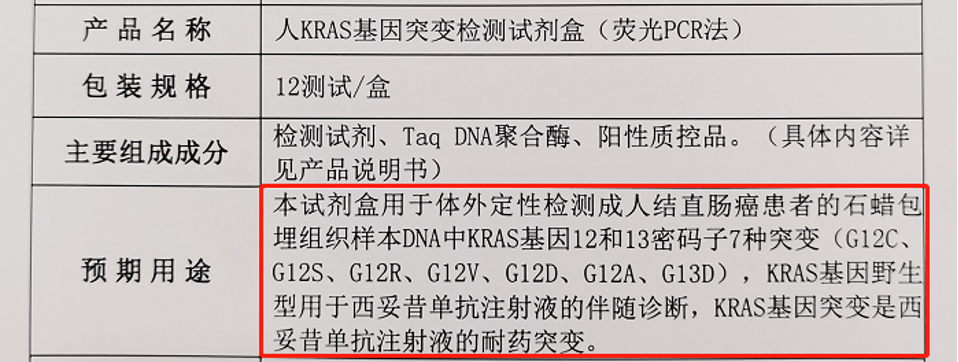
该试剂盒是国内首款基于PCR平台具有伴随诊断功能的KRAS基因突变检测试剂盒, 可用于体外检测成人结直肠癌患者的7种KRAS基因突变,辅助临床医生判断患者使用西妥昔单抗注射液的获益情况。

人KRAS 基因突变检测试剂盒(荧光 PCR 法)外观
KRAS是结直肠癌中常见的驱动基因,在中国结直肠癌患者中的突变率约为30~40%。临床研究表明,KRAS 基因突变与EGFR 单克隆抗体——西妥昔单抗的疗效明确相关:KRAS 野生型患者可以从西妥昔单抗治疗中获益,而 KRAS 突变型患者则会对西妥昔单抗的治疗产生耐药。目前国内外多个权威指南均指出,结直肠癌患者应进行RAS和BRAF基因检测,从而制定更有效、更具个性化的治疗方案。
近年来,雅康博生物基于实时荧光定量PCR平台,自主研发了佰康安®系列产品。至此,已有EGFR、ALK、BRAF、PIK3CA、NRAS、KRAS共6款PCR试剂盒产品获NMPA批准,覆盖肺癌、结直肠癌、甲状腺癌和乳腺癌,众多产品的获批证明了雅康博生物在PCR分子诊断领域的领先地位。
值得注意的是,目前佰康安®系列已有多款试剂盒被国内NGS企业采用,作为临床注册的对照产品,获得了业内的高度认可。本次获批的KRAS基因突变检测试剂盒,是雅康博生物首个以伴随诊断试剂标准获批的注册产品,延续了佰康安®系列简单快速、灵敏准确、易普及等优点。今后,雅康博生物将继续秉承“以专立业、 以质取胜” 的企业理念,深耕伴随诊断产品的研发,深入拓展与国内外药企的合作,全力打造伴随诊断行业领军企业。

9月24日,莲和医疗与雅康博生物顺利完成战略合并,并以全新形象精彩亮相2020年CSCO学术年会。作为分别致力于NGS平台和PCR平台的肿瘤精准医疗技术研发、诊断产品和检验服务企业,两家公司合并将实现优势互补,共同打造精准医疗领域兼具产品化与服务化的伴随诊断行业领军企业。
莲和医疗是国内肿瘤NGS基因检测头部企业,旗下NGS基因检测产品全面覆盖泌尿系统肿瘤、妇科、乳腺肿瘤、消化道肿瘤、肺癌及泛实体瘤的临床和科研需求。莲和医疗拥有深厚的技术和数据积淀,以泌尿生殖系统肿瘤和妇瘤检测为特色,以呼吸道肿瘤和消化道肿瘤检测为重点,开发了领先的建库技术、生信分析技术和独家HRD检测技术。目前,莲和医疗服务网络已覆盖全国22个省市,与近300家三级甲等医院及肿瘤专科医院机构建立了精准医疗科研合作关系。
雅康博生物是国内肿瘤伴随诊断PCR领域TOP2企业,技术底蕴深厚,拥有包括IHC、PCR、FISH、Sanger测序、NGS在内的全面技术平台,肿瘤伴随诊断产品也是同行业企业NGS产品的常用临床试验对照试剂盒。目前,雅康博生物销售网络已覆盖全国28个省市、逾千家大型专业医疗机构。
此次战略合并后,新公司将拥有肿瘤伴随诊断全面技术平台,以及一支更加完整的从技术创新到产品研发、从注册生产到市场销售的专业优势团队,能够进一步整合伴随诊断专业技术平台与渠道资源,打造国内兼具产品化(试剂盒)与服务化(外检及科研服务)的肿瘤伴随诊断平台,试剂盒产品和服务涵盖多个癌种,市场销售网络覆盖全国逾千家大型医院和机构客户,成为业务规模领先的企业,造福千百万肿瘤患者。







